Peróxido

Los peróxidos son sustancias que presentan un enlace oxígeno-oxígeno y que contienen el oxígeno en estado de oxidación −2.[1][2] La fórmula general de los peróxidos es Metal + O22-. Generalmente se comportan como sustancias oxidantes.[3]
En contacto con material combustible pueden provocar incendios o incluso explosiones. Sin embargo, frente a oxidantes fuertes como el permanganato, pueden actuar como reductores oxidándose a oxígeno elemental. Es importante señalar que el peróxido tiene carga.
En pocas palabras, son óxidos que presentan mayor cantidad de oxígeno que un óxido normal y en su estructura manifiestan un enlace covalente sencillo apolar entre oxígeno y oxígeno.
Los peróxidos ganan importancia industrial debido a su efecto blanqueador sobre sustancias orgánicas. Se añaden a detergentes, entre otras cosas bajo el nombre publicitario de “oxígeno activo”, o se utilizan en productos para teñir el cabello. Otros campos de aplicación incluyen la industria química, en la que los peróxidos se utilizan para la síntesis o se presentan como productos intermedios, así como la medicina. El peróxido de hidrógeno (H2O2) es el peróxido más importante económicamente con un volumen de producción anual de más de 2.000.000 toneladas.
Historia
[editar]Como probablemente el primer compuesto de peróxido producido sintéticamente, Alexander v. Humboldt en 1799 en un intento de descomponer el aire con peróxido de bario. No fue hasta 19 años después que Thénard se dio cuenta de que esta sal podría usarse para producir un compuesto previamente desconocido al que llamó agua oxidada, ahora conocido como peróxido de hidrógeno.[4] En 1811 Thénard y Gay-Lussac presentaron el primer peróxido. En los esfuerzos de investigación sostenidos durante las siguientes décadas, se investigó el peróxido de hidrógeno y sus sales. En la búsqueda de un uso, se reconoció desde el principio el efecto blanqueador del compuesto sobre los tintes naturales. Sin embargo, el uso industrial fracasó inicialmente porque solo se podían producir soluciones de peróxido de bario contaminadas y débilmente concentradas. La primera planta industrial para la síntesis de peróxido de hidrógeno se construyó en Berlín en 1873. Solo después del descubrimiento de la síntesis de peróxido de hidrógeno por electrólisis del ácido sulfúrico se pudieron desarrollar procesos mejorados sobre una base electroquímica. La primera fábrica en utilizar este método se abrió en 1908 Weißenstein en Carintia. El proceso de antraquinona que todavía se utiliza en la actualidad fue desarrollado por IG Farben en Ludwigshafen en la década de 1930. Con procesos de síntesis más modernos y la expansión del campo de aplicación, la producción anual de peróxido de hidrógeno aumentó bruscamente de 35.000 t en 1950 a 100.000 t en 1960 a 300.000 t en 1970. En 1998 había una capacidad de producción mundial de 2.700.000 t por año.[5]
Ocurrencia
[editar]En el medio ambiente
[editar]
Los peróxidos suelen ser muy reactivos, por lo que hay pocas ocurrencias naturales. Además del peróxido de hidrógeno, esto incluye algunas sustancias vegetales naturales como un derivado peroxídico de prostaglandina y ascaridol. El peróxido de hidrógeno se encuentra naturalmente en las aguas superficiales, subterráneas y en la atmósfera terrestre. La formación tiene lugar aquí mediante la acción de sustancias catalíticamente activas ligeras o naturales del agua. El agua de mar contiene de 0,5 a 14 μg/l, el agua dulce de 1 a 30 μg/l y aire de 0,1 a 1 ppb.[5]
Se conocen dos minerales que contienen peróxido, la studtita y la metastudita. Estos son peróxidos de uranilo con diferentes cantidades de agua de cristalización en la estructura. El peróxido inestable se crea durante la radiólisis del agua por la radiación alfa del uranio. Aparte de en los depósitos naturales de uranio, estos compuestos también se forman en la superficie de los desechos radiactivos y, por lo tanto, su estabilidad podría ser importante para el almacenamiento final de los desechos de uranio.[6]
Síntesis
[editar]El peróxido más conocido y principal compuesto de partida en la síntesis de otros peróxidos es el peróxido de hidrógeno (H2O2). Hoy en día se suele obtener por autooxidación de naftohidroquinona. Antiguamente se utilizaba la formación de peróxido de bario o la hidrólisis de persulfatos que a su vez se generaban por electrólisis de sulfatos en disolución acuosa con altas densidades de corriente por superficie del electrodo.
Muchas sustancias orgánicas pueden convertirse en hidroperóxidos en reacciones de autooxidación en presencia de luz y oxígeno atmosférico. Especialmente peligroso es la formación a partir de éteres ya que estos se transforman muy fácilmente y los peróxidos se suelen enriquecer en el residuo de una posterior destilación. Allí pueden producir explosiones muy fuertes. Muchos de los accidentes más trágicos de laboratorio se deben a este tipo de reacción. Por lo tanto antes de destilar cantidades mayores de estos disolventes hay que probar la presencia de peróxidos con papel impregnado de yoduro de potasio y almidón. La formación de un color azulado u oscuro indica la presencia de peróxido. (El peróxido oxida el yoduro a yodo elemental que, a su vez, forma con el almidón un complejo de inclusión del color característico oscuro).
Peróxidos inorgánicos
[editar]
El grupo de peróxidos inorgánicos se divide en la clase de sales peróxidos iónicas y ácidos peróxidos inorgánicos, que llevan unidades de peróxido unidas por covalentemente. Mientras que los peróxidos de metales alcalinos y metales alcalinotérreos son de importancia técnica en la primera clase, el peróxido de hidrógeno es el representante más destacado de los peróxidos covalentes. Además, también son importantes una serie de peróxidos de ácidos minerales como el ácido carboxílico y el ácido percarbónico. Frente al carácter puramente iónico de los peróxidos de los metales alcalinos, los peróxidos de los metales de transición tienen un carácter más covalente, lo que se debe a su mayor electronegatividad.[7]
Síntesis
[editar]Síntesis de peróxidos iónicos
[editar]Los peróxidos de metales alcalinos, con la excepción del peróxido de litio, pueden formarse directamente oxidando el elemento con oxígeno a presión normal.[7]
- M = Metal alcalino.
El peróxido de litio, por su parte, puede sintetizarse haciendo reaccionar hidróxido de litio con peróxido de hidrógeno.[7]
Históricamente utilizado para la producción de peróxido de hidrógeno, el peróxido de bario puede obtenerse oxidando óxido de bario a temperatura y presión elevadas.[8].
Síntesis de peróxidos covalentes
[editar]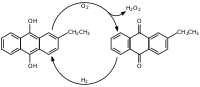
El proceso más utilizado para sintetizar peróxido de hidrógeno es el proceso de la antraquinona. En este proceso, la antraquinona es primero catalizada por paladio e hidrogenada con hidrógeno molecular. En un segundo paso, la antrahidroquinona libera peróxido de hidrógeno mediante oxidación con oxígeno molecular, con reformación de la antraquinona.[8] La ecuación bruta de reacción por lo tanto es:
La síntesis directa de peróxido de hidrógeno a partir del elementos no es posible actualmente a escala industrial, ya que sólo se forma en pequeña medida.[8] Muchos ácidos minerales peroxídicos pueden sintetizarse por anódica de los ácidos subyacentes. Por ejemplo, peroxodisulfatos[9] y percarbonatos[10] accesible de esta manera.
El ácido peroxodisulfúrico se utilizó históricamente para producir peróxido de hidrógeno en un proceso desarrollado a principios del siglo XX. El ácido peroxodisulfúrico obtenido por oxidación se convertía en peróxido de hidrógeno y ácido sulfúrico por hidrólisis.[8]
Propiedades
[editar]En general, se pueden formular pocas reacciones para las reacciones de las sales de peróxido. Para todas las sales de peróxido, la liberación de peróxido de hidrógeno se produce cuando se añade un exceso de ácidos diluidos.[7]
La hidrólisis ácida del peróxido de sodio a sosa cáustica y peróxido de hidrógeno.
La reacción con el agua, así como la termólisis de la sal, da lugar a la formación de nascente oxígeno.[7]
- Hidrólisis de peróxido de sodio a hidróxido de sodio y oxígeno.
- Termólisis de peróxido de sodio a óxido de sodio y oxígeno.
Uso
[editar]Los peróxidos son agentes oxidantes potentes y pueden utilizarse para oxidar otros compuestos.
Los peróxidos de metales alcalinos pueden utilizarse para sintetizar peróxidos orgánicos. Un ejemplo es la reacción de peróxido de sodio con cloruro de benzoilo para obtener peróxido de dibenzoilo.[11]
Muchos peróxidos inorgánicos se utilizan como agentes blanqueadores en la industria textil y en la industria papelera.[8] Debido al creciente desarrollo de procesos de blanqueo respetuosos con el medio ambiente, el uso de compuestos que contienen peróxido ha aumentado considerablemente y ha sustituido en gran medida el enfoque más antiguo basado en el efecto blanqueador de los compuestos que contienen cloro. Los principales ámbitos de aplicación en el hogar incluyen el uso en detergentess.[12] En el pasado, se utilizaban perboratos para este fin, que fueron sustituidos en gran medida por percarbonatos debido al aumento de las concentraciones de boroen el medio ambiente. El uso de compuestos de peróxido en los detergentes también se refleja en sus nombres comerciales. El nombre del detergente Persil, por ejemplo, está formado por las palabras Perborato y silicato'.
Al reaccionar con dióxido de carbono, el oxígeno puede liberarse de algunas sales de peróxido para formar sales de carbonato. Esto se utiliza en generadores de oxígeno, por ejemplo en aparatos de respiración, submarinos o cápsulas espaciales. Para generar oxígeno, se transforma el dióxido de carbono no deseado del aire respirable, que se libera al medio ambiente como producto metabólico, y se libera el oxígeno necesario. En la mayoría de los casos, se utiliza peróxido de sodio para este fin, pero en las cápsulas espaciales se emplea peróxido de litio, ya que tiene una masa molar menor y es capaz de generar un volumen relativamente mayor de oxígeno por unidad de peso.[8]
Reacción del peróxido de sodio con dióxido de carbono para formar carbonato de sodio y oxígeno.
Históricamente, el peróxido de bario se utilizaba para producir oxígeno puro a partir del aire. Para ello se utilizaba el equilibrio dependiente de la temperatura entre el óxido de bario y el peróxido. El peróxido de bario se formaba inicialmente a 500 °C haciendo reaccionar óxido de bario con aire. A temperaturas superiores a 700 °C, esto libera oxígeno con la reformación del óxido de bario.[8]
Peróxido de calcio CaO2 se utiliza como agente aireante liberador de oxígeno en suelos y lodos de estanques, en los USA también como aditivo alimentario para aflojar la masa.[13].
Propiedades
[editar]El enlace O-O es inestable debido al grado de oxidación del oxígeno igual a -1 (excepción). Por tanto, el grupo funcional es muy reactivo y puede reaccionar como oxidante (caso más común) o como agente reductor para lograr grados de oxidación más estables. Otra propiedad de este grupo es su capacidad para formar radicales por escisión homolítica del enlace O-O. Esta escisión puede iniciarse térmicamente, por catálisis o por UV. Un peróxido se caracteriza en particular por su temperatura de vida media T ½ (dada por una vida-media t ½ de 10 h y 1 h), su tasa de masa de oxígeno activo, su temperatura de descomposición autoacelerada (TDAA), su temperatura máxima de almacenamiento y su rango de temperatura de uso; algunos parámetros permiten la clasificación según la estabilidad .
Algunas moléculas se consideran muy peligrosas porque presentan importantes riesgos de incendio y explosión. Algunos grados incorporan un flemador. Generalmente se recomienda almacenar los peróxidos por separado para evitar cualquier reacción con otras moléculas.
Usos
[editar]Parámetro de análisis en la industria alimentaria
[editar]En la industria alimentaria se utiliza como parámetro para medir la calidad de los aceites y las grasas, los cuales son susceptibles de enranciarse o descomponerse, mediante la técnica de medición del índice de peróxido (o índice de peroxidación); siendo la peroxidación una de las causas que provoca características rechazables en la calidad de los alimentos (tales como aceites, entre otros).
Aplicaciones químicas
[editar]Igualmente las aplicaciones de los peróxidos son muy versátiles (desde la peluquería donde se emplean en tintes para aclarar el pelo hasta en combustibles de cohetes).
En la industria química se utilizan en la obtención de los epóxidos, en diversas reacciones de oxidación, como iniciadores de reacciones radicalarias por ejemplo para endurecer poliésteres o en la fabricación del glicerol a partir del alcohol hidroxipropénico. El ácido peroxi-trifluoroacético (F3C–C(=O)–O–O–H) es un desinfectante muy potente y se emplea como tal en la industria farmacéutica. En odontología se utiliza para el blanqueamiento de los dientes, ya sea aplicado en gel o en bandas impregnadas de peróxido en concentraciones de 9 %, 16 % y 25 %.
Estado de oxidación
[editar]El estado de oxidación del oxígeno en los grupos peróxido es -2
Analítica
[editar]Los peróxidos dan una coloración anaranjada con disoluciones de óxido de titanio en ácido sulfúrico concentrado.
Con dicromato de potasio forman el peróxido de cromo (VI) de color azul que puede ser extraído con éter etílico.
Medidas de seguridad
[editar]Los peróxidos son compuestos inestables y pueden presentar un comportamiento explosivo, especialmente en concentraciones elevadas y a temperaturas elevadas. Además, son inflamables y pueden reaccionar con sustancias oxidables (incluidos el algodón y la celulosa) con desarrollo de fuego.[14] Por este motivo, deben observarse una serie de medidas de seguridad al trabajar con peróxidos:
- La descomposición de los peróxidos para formar radicales se ve favorecida por el aumento de la temperatura y la exposición a la luz. Por esta razón, los compuestos de peróxido deben almacenarse en recipientes frescos y opacos.
- Las sustancias que tienden a formar peróxidos por autooxidación, por ejemplo el éter dietílico o el tetrahidrofurano (THF), deben almacenarse en frascos oscuros u opacos y mantenerse sobre hidróxido sódico.
- Si se sospecha la presencia de peróxidos, compruébela antes de calentar o concentrar una solución de reacción.
- Las pequeñas cantidades de peróxidos que escapan de los recipientes de almacenamiento o reacción deben destruirse añadiendo agentes reductores como sulfato ferroso. Sólo entonces se podrá absorber la contaminación de forma segura con papel.
La manipulación industrial segura de peróxidos requiere amplias medidas de seguridad. Los peróxidos orgánicos se producen industrialmente en estructuras celulares (protección contra explosiones). El equipo suele instalarse en celdas de hormigón con ventanas de aluminio para aliviar la presión en caso de explosión. Otras medidas de seguridad incluyen zanjas llenas de agua delante de las células de producción, que pueden inundarse con la solución de reacción en caso de fuga térmica. Después de la producción y el llenado en contenedores pequeños, los compuestos de peróxido deben transportarse rápidamente a un lugar de almacenamiento refrigerado.
Las normas detalladas sobre prevención de accidentes están contenidas en el reglamento de asociaciones profesionales reglamento DGUV 13.
Referencias
[editar]- ↑ IUPAC, Compendium of Chemical Terminology (2006). «Peroxides» (en inglés). Consultado el 28 de septiembre de 2015.
- ↑ IUPAC, Compendium of Chemical Terminology (2006). «Oxidation state» (en inglés). Consultado el 28 de septiembre de 2015.
- ↑ «Peróxido de hidrógeno». ATSDR. NaN de abril de 2002. Consultado el 23 de mayo de 2015.
- ↑ L. W. Gilbert (Hrsg.): Der tropfbar flüssige Sauerstoff, oder das oxygenierte Wasser, in: Ann. der Physik 1820, S. 3, Leipzig
- ↑ a b H. Offermanns, G. Dittrich, N. Steiner: Wasserstoffperoxid in Umweltschutz und Synthese, in: Chemie in unserer Zeit 2000, 34, 150–159.
- ↑ Karrie-Ann Hughes Kubatko, Katheryn B. Helean, Alexandra Navrotsky, Peter C. Burns: Stability of Peroxide-Containing Uranyl Minerals. In: Science. 302, 2003, pag. 1191–1193,
- ↑ a b c d e I. I. Vol'nov: Peróxidos, superóxidos y ozónidos de metales alcalinos y alcalinotérreos, 1ª edición, pp. 21-51, Plenum Press, Nueva York, 1966', sin ISBN.
- ↑ a b c d e f g {{Holleman-Wiberg|edición=101.|páginainicial=531|páginafinal=538}
- ↑ Jander, Blasius, Strähle: Einführung in das anorganisch-chemische Praktikum. 14ª edición. S. 311-312, Hirzel Verlag, Stuttgart 1995, ISBN 978-3-7776-0672-9.
- ↑ E. H. Riesenfeld, B. Reinhold: Die Existenz echter Percarbonate und ihre Unterscheidung von Carbonaten mit Krystall-Wasserstoffsuperoxyd, en: Berichte Dtsch. Chem. Ges.]' 1909, 42, 4377-4383; doi:10.1002/cber.19090420428.
- ↑ S. Gambarjan: Diphenylamine and acyl peroxides, en: Chem. Ber.', 1909', 42, 4003-4013; doi:10.1002/cber.190904203164.
- ↑ Enciclopedia de Química Industrial de Ulmann, vol. A 19, 5ª ed., VCH, págs. 177-197, VCH, pp. 177-197, VCH, Weinheim, 1991, ISBN 3-527-20138-6.
- ↑ Información sobre productos compatibles con el medio ambiente para la oxidación de sedimentos y la fijación de fosfatos, publicación de la empresa PDF file
- ↑ Colectivo de autores: Organikum. 21ª edición, pp. 741-762, Wiley-VCH, 2001', ISBN 3-527-29985-8.
Véase también
[editar]












