Parálisis tirotóxica periódica
| Parálisis Periódica Tirotoxica | ||
|---|---|---|
 La Parálisis periódica tirotoxica ocurre cuando los niveles de tiroxina y triyodotironina se incrementan y se alteran los gradientes eléctricos de las membranas celulares debido a alteraciones en los canales iónicos. | ||
| Especialidad | Neurología | |
La Parálisis Tirotoxica Periódica es una enfermedad caracterizada por un cuadro de hipertiroidismo (sobreactividad de la glándula tiroides) en el que concurren episodios de debilidad muscular y episodios de hipopotasemia (nivel de potasio disminuido en sangre). Se caracteriza por tener una predominio en pacientes masculinos descendientes de chinos, japoneses, vietnamitas, filipinos, y coreanos.[1] La condición puede constituir una amenaza para la vida si la debilidad de los músculos de la respiración es suficiente para producir una insuficiencia respiratoria, o si los niveles de potasio disminuyen a un nivel que produzca arritmias cardíacas (irregularidades en el ritmo cardíaco).[1][2] Sin tratamiento suele ser de naturaleza recurrente.[1] Es parte de un grupo de enfermedades que pueden causar parálisis periódica.[3]
La enfermedad ha sido asociada a mutaciones en genes que codifican para canales iónicos que intercambian electrólitos (sodio y potasio) a través de la membrana celular. Los más implicados son los canales de calcio tipo L subunidad α1 (Cav1.1) y el canal de potasio de rectificación interna 2.6(Kir2.6); por lo tanto la enfermedad es clasificada como una canalopatia.[1][4][4] Ésta conduce a anormalidades en el gradiente de electrolitos bajo condiciones de tirotoxicosis (niveles altos de hormona tiroides en sangre) y la presencia de factores adicionales precipitantes.
El tratamiento de la hipopotasemia, así como la posterior corrección del hipertiroidismo son necesarios para la resolución de los ataques.
Cuadro clínico
[editar]Los ataques inician a menudo con dolor, calambres, y rigidez muscular.[5] seguidos de debilidad o parálisis que tiende a desarrollarse rápidamente, normalmente durante las horas previas al anochecer o las primeras horas de la mañana. La debilidad es normalmente simétrica; con afectación predominante de grupos proximales, tiende a empezar en las piernas y extenderse a brazos.[5] Los grupos musculares de la boca, garganta, ojos, y la respiración normalmente no son afectados, pero ocasionalmente la debilidad de los músculos respiratorios puede causar insuficiencia respiratoria. Los episodios suelen resolverse en un plazo de varias horas a varios días, incluso sin tratamiento.[1][2][5] En el examen neurológico se observa debilidad flácida de piernas; reflejos normalmente disminuidos con integridad del sistema sensorial.[1][5] El estado mental no suele estar afectado.[5]
Los episodios pueden precipitarse tras una actividad física extenuante, ingesta de alcohol, consumo alto de carbohidratos o sal. Esto puede explicar por qué los ataques son más comunes en verano, cuándo las personas aumentan su consumo de bebidas azucaradas y hacen ejercicio. Los ataques relacionados al ejercicio tienden a ocurrir durante el periodo de descanso inmediato posterior al término del ejercicio; el ejercicio, por lo tanto, puede ser recomendado para abortar un ataque.[1]
Puede haber síntomas de hipertiroidismo como pérdida de peso, un ritmo cardíaco rápido, temblor, y sudoración profusa; pero tales síntomas ocurren solo en la mitad de todos los casos.[1][2][5] El tipo más común de hipertiroidismo, la enfermedad de Graves, puede además provocar problemas oculares (oftalmopatia de la enfermedad de Graves) y cambios en la piel de las piernas (mixedema pretibial).[6] La enfermedad tiroidea puede también provocar debilidad muscular en la forma de miopatía tirotóxica pero esta es constante y no episódica.[5]
Etiología
[editar]Genética
[editar]Mutaciones genéticas en los canales de calcio tipo L subunidad α1 (Cav1.1) fueron descritas en poblaciones del sur de China con PTP. Las mutaciones están localizadas en una parte diferente del gen de aquellos descritos en la condición relacionada parálisis periódica familiar hipopotasémica. En la PTP, las mutaciones que se describieron son polimorfismos de un único nucleótido localizados en el elemento de respuesta a la hormona tiroidea, lo que implica que la transcripción del gen y la producción de canales de iones pueden ser alterados por niveles aumentados de dicha hormona. Otras mutaciones han sido implicadas en el gen codificador para el miembro 4 de los canales de potasio dependientes de voltaje relacionados con la subfamilia Shaw (Kv3.4) y la subunidad alfa del canal de sodio tipo 4 (Na41.4).[1]
De la población con TPP, en 33% se demostró tener mutaciones en KCNJ18, un gen que codifica para Kir2.6, un canal de potasio de rectificación interna. Este gen también tiene un elemento de respuesta a la hormona tiroidea.[4]
Formas seguras de antígeno leucocitaria humano (HLA)—especialmente B46, DR.9, DQB10303, Un2, Bw22, AW19, B17, y DRW8—son más comunes en PTP. Las asociaciones particulares a HLA, el cual juega una función central en la respuesta inmune, podría implicar una causa relacionada con el sistema inmunitario, pero es incierto si esto directamente causa PTP o si aumenta la susceptibilidad a la enfermedad de Graves, una enfermedad autoinmune[1]
Enfermedad tiroidea
[editar]La forma subyacente más común de la enfermedad tiroides asociada con PTP es la enfermedad de Graves, un síndrome originado por una reacción autoinmune que conduce a la sobreproducción de hormona tiroidea.[6] La PTP También ha sido descrito en personas con otros problemas tiroideos como tIroiditis, bocio nodular tóxico, adenoma tóxico, adenoma pituitario productor de TSH, ingestión excesiva de tiroxina o yodo e hipertiroidismo inducido por amiodarona
Patogenia
[editar]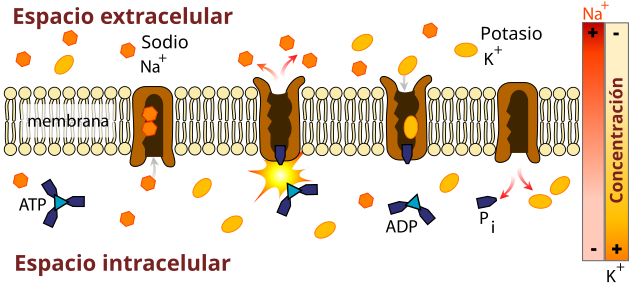
La debilidad muscular y el riesgo aumentado de ritmo cardíaco irregular en el PTP es resultado de la reducción de los niveles de potasio en el torrente sanguíneo. El potasio no se pierde realmente, pero la actividad aumentada de la bomba de Na+/K+ ATPasa (la enzima que mueve el potasio a las células y mantiene sodio en la sangre) mueve el potasio a los tejidos, y lo en agota la circulación. En otros tipos de desequilibrio del potasio, el equilibrio ácido base es normalmente perturbado, con alcalosis metabólica y acidosis metabólica a menudo siendo presente. En TPP, generalmente estos desórdenes están ausentes. La hipopotasemia conduce a la hiperpolarizacion de las células musculares, haciendo a la placa mioneural menos responsiva a los impulsos del nervio y dirigiendo a una disminución de la contractibilidad de los músculos.[1]
No está claro cómo los defectos genéticos descritos aumentan la actividad de la bomba Na+/K+ ATPasa, pero se sospecha que la enzima se activa debido a niveles de hormona tiroidea aumentados. El hipertiroidismo aumenta los niveles de catecolaminas (como adrenalina) en la sangre, aumentando la actividad de la bomba Na+/K+ ATPasa.[5] La actividad enzimática aumenta debido a las causas precipitantes. Por ejemplo, los niveles incrementados de consumo de carbohidratos aumentan los niveles de insulina, lo que se sabe incrementa la actividad de la bomba Na+/K+-ATPase. Una vez el precipitante se retira, la actividad de la enzima regresa a niveles normales.[1] Se ha postulado que las hormonas masculinas incrementan también la actividad de la bomba, lo que explica por qué el sexo masculino tiene un riesgo más alto de PTP a pesar de que las enfermedades tiroideas son más comunes en mujeres.[2]
La TPT está considerada como el modelo pala las afecciones conocidas como "canalopatias", las cuales han sido asociadas a mutaciones de los canales iónicos. La mayoría ocurren de forma episódica.[4]
Diagnóstico
[editar]La hipopotasemia (Niveles de potasio de sangre bajos) generalmente ocurre durante los episodios manifestándose con concentraciones de potasio menores a 3.0 mmol/l .Los niveles de magnesio y fosfato se encuentran a menudo también disminuidos. Los niveles de la creatin quinasa también suelen encontrarse elevados en las dos terceras partes de los casos asociados a un grado de daño de músculo; las elevaciones severas sugestivas de rabdomiólisis (destrucción de tejido del músculo) son raras.[1][2] El electrocardiograma (ECG/EKG) puede mostrar taquicardia (un ritmo cardíaco rápido) debido a la enfermedad tiroidea, anormalidades debido a la arritmia cardíaca (fibrilacion auricular, taquicardia ventricular) y cambios de conducción asociaron con la hipopotasemia (ondas U, QRS ensanchando, prolongación de QT y onda T ondulatoria ).[2] En la electromiografia se pueden encontrar cambios similares a aquellos encontrados en miopatías (enfermedades musculares) con una amplitud reducida de los potenciales de acción de músculo compuestos (CMAPs) que se resuelven cuándo el tratamiento ha comenzado.[3][1]
La TPT se distingue de otras formas de parálisis periódica (especialmente la parálisis periódica familiar hipopotasémica) con pruebas de función tiroidea en la sangre. Estos son normales en las otras formas, pero en la tirotoxicosis los niveles de tiroxina y triyodotironina están elevados, con supresión resultante de la TSH producida por la hipófisis.[1][6] Varias otras exámenes son normalmente realizados para separar las causas diferentes de hipertiroidismo.[6]
Tratamiento
[editar]
En la fase aguda de un ataque, la administración de cloruro de potasio (KCl) restaurara al músculo al impedir complicaciones. Se debe tener mucho cuidado pues los niveles de potasio no se encuentran realmente disminuidos en el organismo y es posible provocar una "hiperpotasemia de rebote"; las infusiones lentas de cloruro de potasio son por tanto recomendados mientras se aplica otro tratamiento.[1]
Los efectos de la tirotoxicosis típicamente responden a la administración de un betabloqueador no selectivo, como propranolol debido a que la mayoría de los síntomas esta provocados por un exceso de estimulación adrenérgica en los receptores β-adrenérgicos. Los episodios subsiguientes pueden ser prevenidos al evitar los desencadenantes hasta que la enfermedad de base este controlada.[1]
Epidemiología
[editar]Ocurre predominantemente en pacientes masculinos descendientes de chinos, japoneses, vietnamitas, filipinos, y coreanos, así como tailandeses, con índices más bajos en personas de otras etnicidades.[1][4][1] En personas chinas y japonesas con hipertiroidismo, 1.8–1.9% de ellos presenta la PTP. Esto en contraste a América del Norte, donde los estudios informan un índice de 0.1–0.2%.[1][2] Los nativos americanos, quiénes comparten un fondo genético con asiáticos, tienen un riesgo aumentado.[1]
La edad típica de inicio es de 20 a 40 años. Es desconocido por qué los hombres son predominantemente afectados, con relaciones hombre:mujer de 17:1 a 70:1, a pesar de que la patología tiroidea es más común en mujeres.[1][2]
Historia
[editar]
Después de varios informes de caso en los siglos XVIII y XIX, la parálisis periódica fue descrita por el neurólogo alemán Carl Friedrich Otto Westphal (1833–1890) en 1885.[7][8] En 1926 el médico japonés Tetsushiro Shinosaki de Fukuoka, observó el índice alto de enfermedad tiroidea en personas japonesas con parálisis periódica.[9][10] El primer informe en lengua inglesa fue realizado en 1931 por Dunlap y Kepler, médicos en la Clínica Mayo; describieron la enfermedad en un paciente con características de la enfermedad de Graves[2][10] En 1937 se asocia a la parálisis periódica hipopotasemia, así como la precipitación de eventos con glucosa e insulina.[11][12] Este fenómeno ha sido utilizado como prueba de diagnóstico.[12]
En 1974 se descubrió que el propranolol podría impedir los eventos de tirotoxicosis[13] El concepto de canalopatias y su asociación con mutaciones de canal de ion concretas emergió al final del siglo XX.[1][4][3]
Referencias
[editar]- ↑ a b c d e f g h i j k l m n ñ o p q r s t u v Kung AW (julio de 2006). «Clinical review: Thyrotoxic periodic paralysis: a diagnostic challenge». J. Clin. Endocrinol. Metab. 91 (7): 2490-5. PMID 16608889. doi:10.1210/jc.2006-0356. Archivado desde el original el 13 de diciembre de 2009. Consultado el 28 de mayo de 2016.
- ↑ a b c d e f g h i Pothiwala P; Levine SN (2010). «Analytic review: thyrotoxic periodic paralysis: a review». J. Intensive Care Med. 25 (2): 71-7. PMID 20089526. doi:10.1177/0885066609358849.
- ↑ a b c Fontaine B (2008). «Periodic paralysis». Adv. Genet. Advances in Genetics 63: 3-23. ISBN 978-0-12-374527-9. PMID 19185183. doi:10.1016/S0065-2660(08)01001-8.
- ↑ a b c d e f Ryan DP; Ptácek LJ (octubre de 2010). «Episodic neurological channelopathies». Neuron 68 (2): 282-92. PMID 20955935. doi:10.1016/j.neuron.2010.10.008.
- ↑ a b c d e f g h Lin SH (enero de 2005). «Thyrotoxic periodic paralysis» (PDF). Mayo Clin. Proc. 80 (1): 99-105. PMID 15667036. doi:10.4065/80.1.99. (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- ↑ a b c d Weetman AP (octubre de 2000). «Graves' disease». N. Engl. J. Med. 343 (17): 1236-48. PMID 11071676. doi:10.1056/NEJM200010263431707.
- ↑ Westphal CF (1885). «Über einen merkwürdigen Fall von periodischer Lähmung aller vier Extremitäten mit gleichzeitigem Erlöschen der elektrischen Erregbarkeit während der Lähmung». Berl. Klin. Wochenschr. (en alemán) 22: 489-91 and 509-11.
- ↑ Sternberg D; Tabti N; Hainque B; Fontaine B (28 de abril de 2009). «Hypokalemic Periodic Paralysis». GeneReviews.
- ↑ Shinosaki T (1926). «Klinische Studien über die periodische Extremitätenlähmung». Z. Gesamt. Neurol. Psychiatr. (en alemán) 100 (1): 564-611. doi:10.1007/BF02970940.
- ↑ a b Dunlap H; Kepler K (1931). «A syndrome resembling familial periodic paralysis occurring in the course of exophthalmic goiter». Endocrinology 15 (6): 541-6. doi:10.1210/endo-15-6-541.
- ↑ Aitken RS, Allott EN, Castleden LI, Walker M (1937). «Observations on a case of familial periodic paralysis». Clin. Sci. 3: 47-57.
- ↑ a b McFadzean AJ; Yeung R (febrero de 1967). «Periodic paralysis complicating thyrotoxicosis in Chinese». Br Med J 1 (5538): 451-5. PMC 1840834. PMID 6017520. doi:10.1136/bmj.1.5538.451.
- ↑ Yeung RT; Tse TF (octubre de 1974). «Thyrotoxic periodic paralysis. Effect of propranolol». Am. J. Med. 57 (4): 584-90. PMID 4432863. doi:10.1016/0002-9343(74)90010-2.
