Histidina
| Histidina | ||
|---|---|---|
 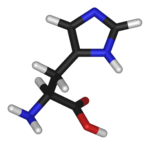 | ||
| Nombre IUPAC | ||
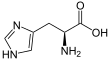
| Ácido 2-amino-3-(1H-imidazol-4-il) propanoico | ||
| General | ||
| Símbolo químico | His, H | |
| Fórmula estructural |
 | |
| Fórmula molecular | C6H9N3O2 | |
| Identificadores | ||
| Número CAS | 71-00-1[1] | |
| ChEBI | 15971 | |
| ChEMBL | CHEMBL17962 | |
| ChemSpider | 6038 | |
| DrugBank | DB00117 | |
| PubChem | 6274 | |
| UNII | 4QD397987E | |
| KEGG | C00135 | |
|
C1=C(NC=N1)CC(C(=O)O)N
| ||
| Propiedades físicas | ||
| Masa molar | 15 516 g/mol | |
| Punto de fusión | 560 K (287 °C) | |
| Propiedades químicas | ||
| Acidez | 1,70; 6,04; 9,09 pKa | |
| Familia | Aminoácido | |
| Esencial | Sí | |
| Codón | CAU, CAC | |
| Punto isoeléctrico (pH) | 7,59 | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
La histidina es un aminoácido esencial en animales (no puede ser fabricado por el propio organismo y debe ser ingerido en la dieta), mientras que bacterias, hongos y plantas pueden biosintetizarlo[2]. Es uno de los 20 aminoácidos que forman parte de las proteínas codificadas genéticamente. Se abrevia como His o H. Su grupo funcional es un imidazol cargado positivamente. Fue purificado por primera vez por Albrecht Kossel en 1896, Alemania.
Los productos lácteos, la carne, el pollo y el pescado contienen histidina. La histidina es un precursor de la histamina, en la que se transforma mediante una descarboxilación. La histamina es una sustancia liberada por las células del sistema inmune durante una reacción alérgica. Participa también en el desarrollo y mantención de los tejidos sanos, particularmente en la mielina que cubre las neuronas.
Propiedades químicas
El aminoácido tiene un pKa de 6,5. Esto significa que, pequeñas variaciones del pH fisiológico cambiarán su carga total. Por debajo de un pH de 6, el anillo imidazol está mayoritariamente protonado, con carga positiva. El anillo imidazol es también Hidrocarburo aromático.
Durante la catálisis, el nitrógeno básico de la histidina es capaz de captar un protón de la serina, tironina y cisteína, por eso forma parte del centro catalítico de determinados enzimas.
Su cadena lateral está cargada positivamente (aminoácido básico) a valores de pH fisiológico. De los veinte alfa-aminoácidos, únicamente la histidina (con un pkH=6) ioniza dentro de la escala de pH fisiológicos. A un pH de 6, su grupo lateral imidazol sólo está cargado en un 50% lo que hace que la histidina sea neutra en un extremo básico del espectro de pH fisiológico. Este hecho tiene como consecuencia que las cadenas laterales de la histidina participen en las reacciones catalíticas de las enzimas.
En lo que respecta a su papel en la molécula de hemoglobina, el quinto ligando del hemo Fe(II) es HisF8, la histidina proximal (cercana). En la oxihemoglobina el Fe(II) está posicionado o,22 Å fuera del plano del hemo de la lado de la histidina proximal y, además, está coordinado por oxígeno. La histidina distal (distante) se une mediante un puente de hidrógeno al oxígeno. En la hemoglobina la sexta posición del ligando Fe (II) se movió hasta un punto de 0,55 Å fuera del plano del hemo.
Se degrada por alfa-cetoglutarato, aunque la conversión de la histidina en glutamato es más complicada respecto a la del resto de aminoácidos que se degradan mediante esta reacción. Se desamina de forma no oxidativa, luego se hidrata y su anillo imizol se cliva para formar N-formiminoglutamato. Luego el grupo formimino transfiere el tetrahidrofolato para formar ácido glutámico y N5-formimino-tetrahidrofolato.
Biosíntesis de la histidina
Cinco de los seis átomos de la histidina derivan del 5-fosforribosil-alfa-pirofosfato(PRPP) un intermediario también involucrado en la biosíntesis del triptófano, los nucleótidos de purina y los de pirimidina. El sexto carbono de la histidina se origina a partir del ATP. Los átomos de ATP que no se incorporan en la histidina se eliminan como 5-aminoimidazol-4-carboxamida ribonucleótido que también es un intermediario en la síntesis de purinas. La biosíntesis inusual de la histidina a partir de una purina se citó como evidencia que apoya la hipótesis de que la vida en su origen se basó en el RNA. Los residuos de histidina son con frecuencia componentes de los centros activos de las enzimas, donde actúan como nucleófilos o catalizadores generales ácido-base, o ambos. Por consiguiente, el descubrimiento de que el RNA tiene propiedades catalíticas sugiere que la mitad imidazol de las purinas cumple un papel similar en estos enzimas RNA (ribozimas). Esto sugiere que la vía de la síntesis de la histidina es un fósil de la transición hacia una forma de vida más eficiente basada en proteínas.
Características y beneficios
Al remover el grupo Ácido carboxílico de la histidina, por la enzima histidina descarboxilasa la convierte a histamina, una importante sustancia fisiológica que se encuentra libremente presente en el intestino y en los gránulos basófilos de las células del Sistema fagocítico mononuclear.
La histamina es un poderoso vasodilatador, y está involucrado en reacciones alérgicas, como la urticaria e inflamación. La histamina también estimula la secreción de pepsina y ácido clorhídrico por el estómago.
La histidina se encuentra elevada en plasma y cerebro durante deficiencias de proteínas y también en algunas condiciones patológicas, lo que dirige la posibilidad de provocar efectos directos en funciones del sistema nervioso central.
Usos terapéuticos de la histidina
Este aminoácido es vital para nuestro organismo ya que su descarboxilación permite su transformación en histamina, por lo que es utilizada en el tratamiento de la artritis reumatoide (inflamación y falta de movilidad), enfermedades alérgicas, úlceras y anemia. En combinación con la hormona de crecimiento y otros aminoácidos, contribuye a la reparación de los tejidos, especialmente en el sistema cardiovascular . En el sistema nervioso central es sintetizada y liberada por las neuronas y utilizada como neuromodulador.
Fuera del sistema nervioso es un mediador de medios fisiológicos. La deficiencia de histidina puede causar problemas en la audición. También se sabe que la histidina ayuda en la desintoxicación de metales pesados, ayuda en el tratamiento de la impotencia y la frigidez, mejora la respuesta inmunitaria, ayuda a evitar los vómitos en el embarazo. Es importante también en el mantenimiento de las vainas de mielina que rodean los axones neuronales. Es necesaria también tanto para la producción de glóbulos rojos como blancos en la sangre, protege al organismo de los daños por radiación y reduce la presión arterial.
Enfermedades asociadas
Escombroidosis
La actividad bacteriana presente en algunos alimentos, principalmente en la carne de los pescados (producto de la descomposición bacteriana que se produce después de ser capturado el pez), provoca la degradación del aminoácido histidina presente en la carne, la cual conlleva a que se produzca concentraciones elevadas de histamina en este tipo de alimentos; provocando una intoxicación alimentaria denominada Escombroidosis al aportar histamina al organismo.[3]
Referencias
- ↑ Número CAS
- ↑ Robert A. Ingle: Histidine Biosynthesis. Sin embargo, el ser humano adulto lo produce de manera normal (los niños no). The Arabidopsis Book. American Society of Plant Biologists, 9, e0141. doi:10.1199/tab.0141.
- ↑ A Hijano Baola, P Carreño Freire, JC Estévez Muñoz, C García de la Rasilla Cooper: Sospecha de escombroidosis. SEMERGEN - Medicina de familia. Vol. 31. Núm. 07, julio 2005, doi: 10.1016/S1138-3593(05)72941-5. Consultado el 7 de febrero de 2014.
- BIOQUÍMICA: Fundamentos para medicina y ciencias de la vida / Müller-Sterl, Werner; [Versión española por Josep Joan Centelles Serra].- Barcelona: Reverté, 2008
- BIOQUÍMICA / Donald Voet y Judith G. Voet - 3ª edición - Buenos Aires: Médica Panamericana, 2006. Traducido por: Silvia Rondinone, Diana Klajn y M.V. Preciado
- LEHNINGER: PRINCIPIOS DE BIOQUÍMICA / David L. Nelson y Michael M. Cox - 5ª edición - Barcelona: Ediciones Omega 2009. Traducido por: Claudi M. Cuchillo
