Estructura biomolecular
La estructura biomolecular es la intrincada forma tridimensional plegada que está formada por una molécula de proteína, ADN o ARN, y que es importante para su función. La estructura de estas moléculas puede considerarse en cualquiera de varias escalas de longitud que van desde el nivel de átomos individuales hasta las relaciones entre subunidades proteicas completas. Esta distinción útil entre escalas a menudo se expresa como una descomposición de la estructura molecular en cuatro niveles: primario, secundario, terciario y cuaternario. El andamiaje para esta organización multiescala de la molécula surge en el nivel secundario, donde los elementos estructurales fundamentales son los diversos enlaces de hidrógeno de la molécula. Esto conduce a varios dominios reconocibles de estructura de proteínas y estructura de ácido nucleico, incluidas características de estructura secundaria como hélices alfa y láminas beta para proteínas, y bucles de horquilla, protuberancias y bucles internos para ácidos nucleicos. Los términos estructura primaria, secundaria, terciaria y cuaternaria fueron introducidos por Kaj Ulrik Linderstrøm-Lang en sus Conferencias Médicas Lane 1951 en la Universidad de Stanford.
Estructura primaria[editar]
La estructura primaria de un biopolímero es la especificación exacta de su composición atómica y los enlaces químicos que conectan esos átomos (incluida la estereoquímica). Para un biopolímero típico no ramificado, no reticulado (como una molécula de una proteína intracelular típica, o de ADN o ARN), la estructura primaria es equivalente a especificar la secuencia de sus subunidades monoméricas, como péptidos o nucleótidos.

La estructura primaria a veces se denomina erróneamente secuencia primaria, pero no existe dicho término, así como tampoco hay un concepto paralelo de secuencia secundaria o terciaria. Por convención, la estructura primaria de una proteína se informa a partir del terminal amino (N) al terminal carboxilo (C), mientras que la estructura primaria de la molécula de ADN o ARN se informa desde el extremo 5' hasta el extremo 3'.
La estructura primaria de una molécula de ácido nucleico se refiere a la secuencia exacta de nucleótidos que comprende la molécula completa. A menudo, la estructura primaria codifica motivos de secuencia que son de importancia funcional. Algunos ejemplos de tales motivos son: las cajas C/D[1] y H/ACA[2] de snoRNA, sitios de unión a LSm encontrado en ARN espliceosomal como U1, U2, U4, U5, U6, U12 y U3, la secuencia Shine-Dalgarno,[3] la secuencia consenso de Kozak[4] y el terminador de ARN polimerasa III.[5]
Estructura secundaria[editar]


La estructura secundaria es el patrón de enlaces de hidrógeno en un biopolímero. Estos determinan la forma tridimensional general de los segmentos locales de los biopolímeros, pero no describen la estructura global de las posiciones atómicas específicas en el espacio tridimensional, que se consideran estructuras terciarias. La estructura secundaria está formalmente definida por los enlaces de hidrógeno del biopolímero, como se observa en una estructura de resolución atómica.
En las proteínas, la estructura secundaria está definida por patrones de enlaces de hidrógeno entre los grupos amina y carboxilo de la cadena principal (los enlaces de hidrógeno de cadena lateral-cadena principal y cadena lateral-cadena lateral son irrelevantes), donde se utiliza la definición DSSP de un enlace de hidrógeno. En los ácidos nucleicos, la estructura secundaria se define por el enlace de hidrógeno entre las bases nitrogenadas.
Sin embargo, en la estructura secundaria de las proteínas, el enlace de hidrógeno está correlacionado con otras características estructurales, lo que ha dado lugar a definiciones menos formales de estructura secundaria. Por ejemplo, en los residuos generales de las proteínas, las hélices adoptan ángulos diédricos principales en alguna región de la parcela de Ramachandran; por lo tanto, un segmento de residuos con tales ángulos diédricos a menudo se llama hélice, independientemente de si tiene los enlaces de hidrógeno correctos. Se han propuesto muchas otras definiciones menos formales, a menudo aplicando conceptos de la geometría diferencial de curvas, como la curvatura y la torsión. Los biólogos estructurales que resuelven una nueva estructura de resolución atómica a veces asignan su estructura secundaria a simple vista y registran sus asignaciones en el archivo correspondiente del Banco de datos de proteínas (PDB).
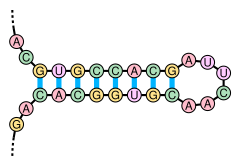
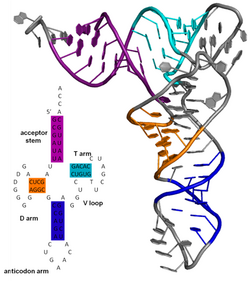
La estructura secundaria de una molécula de ácido nucleico se refiere a las interacciones de emparejamiento de bases dentro de una molécula o conjunto de moléculas que interactúan. La estructura secundaria de los ARN biológicos a menudo se puede descomponer de manera única en tallos y bucles. A menudo, estos elementos o combinaciones de ellos pueden clasificarse adicionalmente, por ejemplo, tetraloops, pseudonudos y bucles de tallo. Hay muchos elementos de estructura secundaria de importancia funcional para el ARN biológico. Ejemplos famosos incluyen los bucles del tallo terminador independientes de Rho y la hoja de trébol de ARN de transferencia (ARNt). Hay una pequeña industria de investigadores que intentan determinar la estructura secundaria de las moléculas de ARN. Los enfoques incluyen métodos experimentales y computacionales.
Estructura terciaria[editar]

La estructura terciaria de las proteínas o cualquier otra macromolécula es su estructura tridimensional, tal como se define por las coordenadas atómicas. Las proteínas y los ácidos nucleicos se pliegan en estructuras tridimensionales complejas que dan como resultado las funciones de las moléculas. Si bien tales estructuras son diversas y complejas, a menudo se componen de motivos y dominios de estructura terciaria recurrentes y reconocibles que sirven como bloques de construcción moleculares. Se considera que la estructura terciaria está determinada en gran medida por la estructura primaria de la biomolécula (su secuencia de aminoácidos o nucleótidos).
Estructura cuaternaria[editar]
La estructura cuaternaria se refiere al número y disposición de múltiples moléculas de proteínas en un complejo de múltiples subunidades.
Para los ácidos nucleicos, el término es menos común, pero puede referirse a la organización de alto nivel de ADN en la cromatina,[6] incluyendo sus interacciones con histonas, o las interacciones entre unidades de ARN separadas en el ribosoma[7][8] o espliceosoma.
Determinación de estructura[editar]
El sondeo de estructuras es el proceso mediante el cual se utilizan técnicas bioquímicas para determinar la estructura biomolecular.[9] Este análisis se puede usar para definir los patrones que se pueden usar para inferir la estructura molecular, el análisis experimental de la estructura y la función molecular, y una mayor comprensión del desarrollo de moléculas más pequeñas para futuras investigaciones biológicas.[10] El análisis de sondeo de estructura se puede realizar a través de muchos métodos diferentes, que incluyen sondeo químico, sondeo de radicales hidroxilo, mapeo de interferencia de nucleótidos análogos (NAIM) y sondeo en línea.
Las estructuras de proteínas y ácidos nucleicos se pueden determinar utilizando espectroscopía de resonancia magnética nuclear (RMN) o cristalografía de rayos X o microscopía electrónica de crioelectrónica de una sola partícula (crioEM). Los primeros informes publicados para el ADN (por Rosalind Franklin y Raymond Gosling en 1953) de los patrones de difracción de rayos X del ADN A y también del ADN B utilizaron análisis basados en transformaciones de la función Patterson que proporcionaron solo una cantidad limitada de información estructural para fibras de ADN aisladas del timo de ternera.[11][12] Se propuso un análisis alternativo en 1953 para difracción de rayos X B-ADN y patrones de dispersión de fibras de ADN hidratadas orientadas a bacterias y cabezas de esperma de trucha en términos de cuadrados de las funciones de Bessel.[13] Aunque la ''forma de ADN B'' es más común en las condiciones que se encuentran en las células,[14] no es una conformación bien definida sino una familia o un conjunto difuso de conformaciones de ADN que ocurren en los altos niveles de hidratación presentes en un amplio espectro variedad de células vivas.[15] Sus patrones de difracción y dispersión de rayos X correspondientes son característicos de los paracristales moleculares con un grado significativo de trastorno (más del 20%),[16][17] y la estructura no es manejable utilizando solo el análisis estándar.
En contraste, el análisis estándar, que involucra solo transformadas de Fourier de las funciones de Bessel y modelos moleculares de ADN, todavía se usa de manera rutinaria para analizar los patrones de difracción de rayos X de A-ADN y Z-ADN.[18]
Predicción de estructura[editar]

La predicción de la estructura biomolecular es la predicción de la estructura tridimensional de una proteína a partir de su secuencia de aminoácidos, o de un ácido nucleico a partir de su secuencia de nucleobase (base). En otras palabras, es la predicción de la estructura secundaria y terciaria a partir de su estructura primaria. La predicción de la estructura es la inversa del diseño biomolecular, como en el diseño racional, el diseño de proteínas, el diseño de ácidos nucleicos y la ingeniería biomolecular.
La predicción de la estructura proteica es uno de los objetivos más importantes que persigue la bioinformática y la química teórica. La predicción de la estructura de las proteínas es de gran importancia en medicina (por ejemplo, en el diseño de fármacos) y biotecnología (por ejemplo, en el diseño de nuevas enzimas). Cada dos años, el rendimiento de los métodos actuales se evalúa en el experimento Evaluación crítica de predicción de estructura de proteínas (CASP).
También ha habido una cantidad significativa de investigación bioinformática dirigida al problema de predicción de la estructura de ARN. Un problema común para los investigadores que trabajan con ARN es determinar la estructura tridimensional de la molécula dada solo la secuencia de ácido nucleico. Sin embargo, en el caso del ARN, gran parte de la estructura final está determinada por la estructura secundaria o las interacciones de apareamiento de bases intramoleculares de la molécula. Esto se demuestra por la alta conservación de los pares de bases en diversas especies.
La estructura secundaria de las pequeñas moléculas de ácido nucleico está determinada en gran medida por interacciones locales fuertes, como los enlaces de hidrógeno y el apilamiento de bases. Sumar la energía libre para tales interacciones, generalmente usando un método del vecino más cercano, proporciona una aproximación para la estabilidad de la estructura dada.[19] La forma más sencilla de encontrar la estructura de energía libre más baja sería generar todas las estructuras posibles y calcular la energía libre para ellas, pero el número de estructuras posibles para una secuencia aumenta exponencialmente con la longitud de la molécula.[20] Para moléculas más largas, el número de posibles estructuras secundarias es enorme.
Los métodos de covarianza de secuencias se basan en la existencia de un conjunto de datos compuesto por múltiples secuencias de ARN homólogas con secuencias relacionadas pero diferentes. Estos métodos analizan la covarianza de sitios base individuales en evolución; el mantenimiento en dos sitios ampliamente separados de un par de nucleótidos de apareamiento de bases indica la presencia de un enlace de hidrógeno estructuralmente requerido entre esas posiciones. Se ha demostrado que el problema general de la predicción de pseudoknot es NP-completo.[21]
Diseño[editar]
El diseño biomolecular puede considerarse el inverso de la predicción de la estructura. En la predicción de la estructura, la estructura se determina a partir de una secuencia conocida, mientras que, en el diseño de proteínas o ácidos nucleicos, se genera una secuencia que formará una estructura deseada.
Otras biomoléculas[editar]
Otras biomoléculas, como los polisacáridos, los polifenoles y los lípidos, también pueden tener una estructura de orden biológico de mayor importancia.
Véase también[editar]
- Biomolecular
- Estructura cuaternaria de las proteínas
- Comparación de software de simulación de ácido nucleico
- Estructura genética
- Lista de software de predicción de estructura de ARN
- ARN no codificante
Referencias[editar]
- ↑ Samarsky, Dmitry A.; Fournier, Maurille J.; Singer, Robert H.; Bertrand, Edouard (1 de julio de 1998). «The snoRNA box C/D motif directs nucleolar targeting and also couples snoRNA synthesis and localization». The EMBO Journal 17 (13): 3747-3757. ISSN 0261-4189. PMC 1170710. PMID 9649444. doi:10.1093/emboj/17.13.3747.
- ↑ Ganot, P.; Caizergues-Ferrer, M.; Kiss, T. (1 de abril de 1997). «The family of box ACA small nucleolar RNAs is defined by an evolutionarily conserved secondary structure and ubiquitous sequence elements essential for RNA accumulation.». Genes & Development (en inglés) 11 (7): 941-956. ISSN 0890-9369. PMID 9106664. doi:10.1101/gad.11.7.941.
- ↑ Shine, J.; Dalgarno, L. (1975-03). «Determinant of cistron specificity in bacterial ribosomes». Nature (en inglés) 254 (5495): 34-38. ISSN 1476-4687. doi:10.1038/254034a0.
- ↑ Kozak, Marilyn (26 de octubre de 1987). «An analysis of 5'-noncoding sequences from 699 vertebrate messenger RNAs». Nucleic Acids Research (en inglés) 15 (20): 8125-8148. ISSN 0305-1048. PMC 306349. PMID 3313277. doi:10.1093/nar/15.20.8125. Consultado el 31 de agosto de 2020.
- ↑ Bogenhagen, Daniel F.; Brown, Donald D. (1 de abril de 1981). «Nucleotide sequences in Xenopus 5S DNA required for transcription termination». Cell (en inglés) 24 (1): 261-270. ISSN 0092-8674. PMID 6263489. doi:10.1016/0092-8674(81)90522-5.
- ↑ Sipski, M. Leonide; Wagner, Thomas E. (1977). «Probing DNA quaternary ordering with circular dichroism spectroscopy: Studies of equine sperm chromosomal fibers». Biopolymers (en inglés) 16 (3): 573-582. ISSN 1097-0282. doi:10.1002/bip.1977.360160308.
- ↑ Noller, Harry F. (1 de junio de 1984). «Structure of ribosomal rna». Annual Review of Biochemistry 53 (1): 119-162. ISSN 0066-4154. doi:10.1146/annurev.bi.53.070184.001003.
- ↑ Nissen, Poul; Ippolito, Joseph A.; Ban, Nenad; Moore, Peter B.; Steitz, Thomas A. (24 de abril de 2001). «RNA tertiary interactions in the large ribosomal subunit: The A-minor motif». Proceedings of the National Academy of Sciences (en inglés) 98 (9): 4899-4903. ISSN 0027-8424. PMC 33135. PMID 11296253. doi:10.1073/pnas.081082398.
- ↑ Teunissen, A. W. M. (1979). RNA Structure Probing: Biochemical structure analysis of autoimmune-related RNA molecules. pp. 1-27. ISBN 978-90-901323-4-1.
- ↑ Probing RNA Structure, Function, and History by Comparative Analysis. Cold Spring Harbor Laboratory Press. 1999. pp. 113-117. ISBN 978-0-87969-589-7.
- ↑ Franklin, R. E. (10 de septiembre de 1953). «The structure of sodium thymonucleate fibres. I. The influence of water content». Acta Crystallographica (en inglés). doi:10.1107/s0365110x53001939.
- ↑ Franklin, Rosalind E.; Gosling, R. G. (1953-04). «Molecular Configuration in Sodium Thymonucleate». Nature (en inglés) 171 (4356): 740-741. ISSN 1476-4687. doi:10.1038/171740a0.
- ↑ Wilkins, M. H. F.; Stokes, A. R.; Wilson, H. R. (1953-04). «Molecular Structure of Nucleic Acids: Molecular Structure of Deoxypentose Nucleic Acids». Nature (en inglés) 171 (4356): 738-740. ISSN 1476-4687. doi:10.1038/171738a0.
- ↑ Leslie, A. G. W.; Arnott, Struther; Chandrasekaran, Rengaswami; Ratliff, R. L. (15 de octubre de 1980). «Polymorphism of DNA double helices». Journal of Molecular Biology (en inglés) 143 (1): 49-72. ISSN 0022-2836. doi:10.1016/0022-2836(80)90124-2.
- ↑ Baianu, Ion C. (1 de enero de 1980). «Structural order and partial disorder in biological systems». Bulletin of Mathematical Biology (en inglés) 42 (1): 137-141. ISSN 1522-9602. doi:10.1007/BF02462372.
- ↑ Direct analysis of diffraction by matter. Amsterdam/New York: North-Holland. 1962.
- ↑ Baianu, I. C. (1 de septiembre de 1978). «X-ray scattering by partially disordered membrane systems». Acta Crystallographica Section A: Crystal Physics, Diffraction, Theoretical and General Crystallography (en inglés) 34 (5): 751-753. ISSN 0567-7394. doi:10.1107/S0567739478001540.
- ↑ «X-Ray Diffraction Patterns of Double-Helical Deoxyribonucleic Acid (DNA) Crystals». planetphysics.org. Archivado desde el original el 24 de julio de 2009.
- ↑ Mathews, David H. (9 de junio de 2006). «Revolutions in RNA Secondary Structure Prediction». Journal of Molecular Biology (en inglés) 359 (3): 526-532. ISSN 0022-2836. doi:10.1016/j.jmb.2006.01.067.
- ↑ Zuker, Michael; Sankoff, David (1 de julio de 1984). «RNA secondary structures and their prediction». Bulletin of Mathematical Biology (en inglés) 46 (4): 591-621. ISSN 1522-9602. doi:10.1007/BF02459506.
- ↑ Lyngsø, Rune B.; Pedersen, Christian N. S. (1 de agosto de 2000). «RNA Pseudoknot Prediction in Energy-Based Models». Journal of Computational Biology 7 (3-4): 409-427. doi:10.1089/106652700750050862.
