Estifnato de plomo
| Estifnato de plomo | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
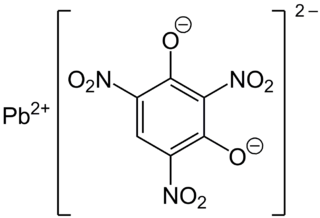
| 2,4,6-trinitrobenceno-1,3-diolato de plomo (II) | ||
| General | ||
| Otros nombres | Tricinato, tricinato de plomo, 2,4,6-trinitroresorcinato de plomo | |
| Fórmula estructural | Estructura en Jmol | |
| Fórmula molecular | C6HN3O8Pb | |
| Identificadores | ||
| Número CAS | 15245-44-0[1] | |
| ChemSpider | 21106132 | |
| PubChem | 61789 | |
| Propiedades físicas | ||
| Densidad | 3060 kg/m³; 3,06 g/cm³ | |
| Masa molar | 450,287 g/mol | |
| Punto de descomposición | 256 °C (529 K) | |
| Propiedades químicas | ||
| Solubilidad en agua | < 0.02% | |
| Termoquímica | ||
| ΔfH0sólido | -836,80 kJ/mol | |
| Peligrosidad | ||
| NFPA 704 |
2
3
4
| |
| Frases R | R3 R20/22 R33 R50/53 R61 R62 | |
| Frases S | S45 S53 S60 S61 | |
| Riesgos | ||
| Ingestión | Náusea, vómito, estreñimiento, retortijones y dolor estomacal. Inducir el vómito, atención médica. | |
| Inhalación | Irritación, tos, dificultad para respirar. Dar aire fresco, respiración artificial de ser necesaria, oxígeno si es necesario, atención médica. | |
| Piel | Enrojecimiento, hinchazón. Lavar con agua abundante, remover ropa contaminada, atención médica. | |
| Ojos | Irritación, enrojecimiento, hinchazón y dolor. Lavar con agua abundante, atención médica. | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El estifnato de plomo (2,4,6-trinitroresorcinato de plomo, C6HN3O8Pb), que es un derivado del ácido estífnico, es un explosivo usado como un componente en cápsulas fulminantes y mezclas detonantes para explosivos secundarios menos sensibles.
Hay varias formas de estifnato de plomo: una forma básica amorfa que es un polvo amarillo, con cristales en forma de aguja o gránulos; una forma básica color rojizo con cristales en forma de prismas cuadrados o platos hexagonales; y el estifnato de plomo normal con cristales amarillo-naranja.[2][3] Es particularmente sensible al fuego y a la descarga de electricidad estática.[4] Cuando está seco, puede ser fácilmente detonado mediante descargas estáticas del cuerpo humano. Cuanto más largos y angostos sean los cristales, será más susceptible el estifnato de plomo a la electricidad estática. El compuesto no reacciona con metales y es menos sensible a los choques que el fulminato de mercurio pero más que la azida de plomo, mientras que es menos sensible a la fricción que ambos compuestos.[3] Es solo ligeramente soluble en agua y metanol y puede ser neutralizado por una disolución de carbonato de sodio. Su almacenamiento debe ser en un lugar fresco, seco y bien ventilado, lejos de cualquier fuente de ignición.
Tal como otros compuestos que contienen plomo, el estifnato de plomo es inherentemente tóxico para los humanos si es ingerido, es decir, puede causar envenenamiento por metal pesado.
Síntesis
[editar]El estifnato de plomo puede sintetizarse haciendo reaccionar nitrato o acetato de plomo con estifnato de sodio o magnesio, en presencia de un medio ácido,[3] o usando algún proceso análogo. Por ejemplo, se puede hacer reaccionar nitrato de plomo con estifnato de magnesio, el cual se obtiene a su vez de una reacción entre el ácido estífnico y carbonato de magnesio:[2]
- C6H(NO2)3(OH)2 + MgCO3 → C6H(NO2)3(O)22- Mg2+ + CO2 + H2O
- C6H(NO2)3(O)22- Mg2+ + Pb(NO3)2 → C6H(NO2)3(O)22- Pb2+ + Mg(NO3)2
Referencias
[editar]- ↑ Número CAS
- ↑ a b Ledgard, Jared (2007). Lulu.com, ed. A Soldiers Handbook, Volume 1: Explosives Operations (en inglés). pp. 64-67. ISBN 9780615147949. Consultado el 3 de agosto de 2012.
- ↑ a b c Headquarters, Department of the Army, ed. (1989). Military Explosives (en inglés). pp. 7/12 - 7/15. Consultado el 3 de agosto de 2012.
- ↑ Akhavan, Jacqueline (2011). Royal Society of Chemistry, ed. The Chemistry of Explosives (en inglés). Ilustrada, revisada (3a edición). pp. 36-37. ISBN 9781849733304. Consultado el 3 de agosto de 2012.
Enlaces externos
[editar]- Ficha en GESTIS Substance database (en inglés)
- Ficha en winchester.com (en inglés)
- Esta obra contiene una traducción derivada de «Lead styphnate» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.

