Átomo de hidrógeno

El átomo de hidrógeno es el átomo más simple que existe y el único que admite una solución analítica exacta desde el punto de vista de la mecánica cuántica. El átomo de hidrógeno es conocido también como átomo monoelectrónico, debido a que está formado por un protón que se encuentra en el núcleo del átomo y que contiene más del 99,945 % de la masa del átomo, y un solo electrón -unas 1836 veces menos masivo que el protón- que "orbita" alrededor de dicho núcleo (aunque también pueden existir átomos de hidrógeno con núcleos formados por un protón y 1 o 2 neutrones más, llamados deuterio y tritio, respectivamente).
Se puede hacer una analogía pedagógica del átomo de hidrógeno con un Sistema Solar, donde el sol sería el único Núcleo atómico y que tiene la mayor cantidad de masa -concretamente es el 99,86 % del Sistema Solar- y en su órbita tuviera un solo planeta (Electrón) que conformaría el resto de la masa del Sistema (átomo de protio (1H)). Esto hace del hidrógeno el más simple de todos los elementos de la tabla periódica de los elementos.
Introducción
[editar]Desde principios del siglo XX se conocía que la mecánica clásica no podía explicar ni la estructura interna del átomo, reflejada en la existencia de líneas espectrales, ni la propia existencia y estabilidad de los átomos. De acuerdo con las predicciones de la mecánica clásica y el electromagnetismo clásico un átomo de hidrógeno formado por un protón y un electrón orbitando a su alrededor no sería un sistema estable, ya que de acuerdo con la electrodinámica clásica una carga en movimiento emite radiación electromagnética.
El electrón al orbitar alrededor de centro de masas del sistema, tendría una gran aceleración y emitiría gran cantidad de fotones, perdiendo así energía y velocidad. La teoría clásica pronosticaba que el electrón caería sobre el núcleo atómico, haciendo que cualquier átomo como sistema físico tuviera una duración muy corta antes de que el electrón cayera sobre el núcleo atómico, al haber perdido la energía cinética en forma de radiación.
Este hecho supuso un enigma para los físicos de principios de siglo XX, que en un intento de explicar este y otros problema de la teoría electromagnética acabaron desarrollando una nueva forma de mecánica, que era la única que podía describir los sistemas de escala atómica llamada mecánica cuántica. En este artículo se mostrará la solución cuántica. Históricamente se ha enseñado esta solución porque además de corroborar los datos experimentales con el modelo teórico cuántico de los átomos, proporciona las herramientas fundamentales de la teoría atómica actual, y provee una solución aproximada pero muy buena para los átomos más complicados.
Estructura electrónica: fracaso del modelo clásico
[editar]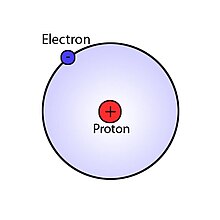
En mecánica clásica, un átomo de hidrógeno es un tipo de problema de los dos cuerpos en que el protón sería el primer cuerpo que tiene más del 99 % de la masa del sistema y el electrón es el segundo cuerpo que es mucho más ligero. Para resolver el problema de los dos cuerpos es conveniente hacer la descripción del sistema, colocando el origen del sistema de referencia en el centro de masa de la partícula de mayor masa, esta descripción es correcta considerando como masa de la otra partícula la masa reducida que viene dada por
Siendo la masa del protón y la masa del electrón. En ese caso el problema del átomo de hidrógeno parece admitir una solución simple en la que el electrón se moviera en órbitas elípticas alrededor del núcleo atómico. Sin embargo, existe un problema con la solución clásica, de acuerdo con las predicciones de electromagnetismo una partícula eléctrica que sigue un movimiento acelerado, como sucedería al describir una elipse debería emitir radiación electromagnética, y por tanto perder energía cinética, la cantidad de energía radiada sería de hecho:
Ese proceso acabaría con el colapso del átomo sobre el núcleo en un tiempo muy corto dadas las grandes aceleraciones existentes. A partir de los datos de la ecuación anterior el tiempo de colapso sería de 10-8 s, es decir, de acuerdo con la física clásica los átomos de hidrógeno no serían estables y no podrían existir más de una cienmillonésima de segundo.
Esa incompatibilidad entre las predicciones del modelo clásico y la realidad observada llevó a buscar un modelo que explicara fenomenológicamente el átomo. El modelo atómico de Bohr era un modelo fenomenológico que explicaba satisfactoriamente algunos datos, como el orden de magnitud del radio atómico y los espectros de absorción del átomo, pero no explicaba como era posible que el electrón no emitiera radiación perdiendo energía. La búsqueda de un modelo físicamente más motivado llevó a la formulación del modelo atómico de Schrödinger en el cual puede probarse que el valor esperado de la acelaración es nulo, y sobre esa base puede decirse que la energía electromagnética emitida debería ser también nula. Sin embargo, la representación cuántica de Schrödinger tiene un alto coste en términos intuitivos.
Estructura electrónica: éxito del modelo cuántico
[editar]El modelo cuántico que explica satisfactoriamente el átomo de hidrógeno, se obtiene aplicando la ecuación de Schrödinger a un problema de una partícula en tres dimensiones dentro de un campo electrostático. En ese modelo el electrón queda descrito por una función de onda que satisface la ecuación de Schrödinger tridimensional, con un potencial de Coulomb que viene dado por:
donde es la constante de Coulomb, es la carga eléctrica del electrón y es la distancia al núcleo atómico, es la constante dieléctrica del vacío. Este potencial modela la interacción entre el protón y el electrón. Gracias a la existencia de la simetría esférica la resolución puede simplificarse usando coordenadas esféricas. En la sección anterior vimos que la ecuación de onda independiente del tiempo de una partícula sometida a un potencial ) en tres dimensiones es
(1a)
donde es la energía total del electrón. Escribiendo la ecuación de Schrödinger en coordenadas esféricas, el laplaciano se escribe como:
(2)
La justificación para utilizar este laplaciano, aunque obviamente tiene una estructura más complicada que su igual de las coordenadas cartesianas, es que es la forma más práctica de realizar la separación de variables, esto también es posible utilizando otro sistema de coordenadas, si el lector desea ver como se realiza le recomiendo L. Schiff Quantum Mechanics. Ahora nuestra ecuación queda escrita
(1b)
esta es una ecuación en derivadas parciales. Usando la técnica de separación de variables la convertimos en tres ecuaciones diferenciales ordinarias, pero se suele separar primero la parte radial de la angular, y eso quiere decir que la solución se reescribe como
de modo que la ecuación queda:
reordenando términos y multiplicando por se puede escribir como
Nótese que la parte izquierda de esta ecuación no depende de las variables de la parte derecha y viceversa, esto quiere decir que la única forma de satisfacer la igualdad es que ambas partes sean igual a una constante, para que la solución sea físicamente aceptable, la constante de separación debe ser de modo que se obtienen dos ecuaciones.
Ecuación angular
[editar]La primera es conocida en física como los armónicos esféricos y es
y en efecto es la ecuación asociada de Laplace en coordenadas esféricas, la solución a esta ecuación es
con
y los los polinomios asociados de Legendre. Estos polinomios son finitos en 0 y como lo requiere la función de onda aceptable, la forma de construir los polinomios es, entre otras, mediante la fórmula de Rodrigues que para estos polinomios es
evaluando después en , la razón por la que la constante de separación se eligió como fue justamente para que la solución fueran estos polinomios, dado que además de ser una solución conocida a la ecuación, es físicamente aceptable, la otra constante aparece al aplicar el método de separación a la ecuación de los armónicos esféricos; y también es notable que la ecuación para proporciona lógicamente, dos soluciones linealmente independientes, sin embargo la otra se descarta porque la densidad de probabilidad debe ser independiente de la coordenada ya que no debe existir una dirección preferencial para encontrar al electrón en el espacio, porque el espacio es isotrópico, la constante además, solo puede ser un entero, y esto se debe a que no sería monovaluada en caso contrario, por otro lado también debe ser un entero, y positivo, para que la solución a la ecuación resultante para luego de la separación de variables sea aceptable, la fórmula de rodrigues se puede además estabelcer una relación entre las constantes, puesto que si el polinomio correspondiente a las constantes dadas se anula y por consiguiente toda la función de onda, en concreto
Ecuación radial
[editar]La otra ecuación es de suma importancia, ya que su solución depende de la forma específica del potencial, de hecho para cualquier potencial esféricamente simétrico la solución anterior es válida, y la solución a esta parte de la ecuación de onda es característica de la forma específica del potencial electrostático, en efecto la ecuación queda
donde se ha sustituido por el potencial electrostático mediante el cual interaccionan el protón y el electrón y aquí
esta ecuación es de una dificultad considerable, pero se puede resolver si se consideran las soluciones asintóticas y luego se ajusta una solución exacta, haciendo el cambio
se tiene que la ecuación se reescribe como
si ahora se hace un cambio de variable
entonces la ecuación queda
ahora otro cambio
y ahora la ecuación es
si se considera ahora que es claro que la ecuación queda
la solución físicamente aceptable bajo esta condición es
luego otra consideración asintótica, el término que depende de crece mucho más rápido que los demás términos, de donde se obtiene
y la solución aceptable en este caso es
si ahora se supone una función tal que
entonces se tendrá que satisfacer la siguiente ecuación
si ahora y además
con y luego se tendría
haciendo ahora
se tiene finalmente
esta es la ecuación generalizada de Laguerre y su solución es
o mejor dicho
donde los son los polinomios asociados de Laguerre y que vienen definidos por la fórmula de Rodrigues
la solución a la ecuación radial se puede entonces escribir
Donde . El cual es el valor esperado del radio para la función de onda en su estado fundamental,
La constante puede ser obtenida mediante la condición de normalización de la función de onda:
Los niveles energéticos del hidrógeno
[editar]En la solución de la parte radial de la ecuación del átomo de hidrógeno, apareció un nuevo entero positivo, de hecho mayor estrictamente que cero, y es , en la ecuación en la que apareció que se estableció[1]
con facilidad se puede verificar que
de donde claramente
que es un resultado coincidente con la experimentación, y además por si fuera poco con el modelo atómico de Bohr.
Los niveles energéticos de los átomos hidrogenoides
[editar]De la deducción anterior es fácil obtener las soluciones para cualquier átomo hidrogenoide. Solamente es necesario considerar que en este caso el potencial electrostático se escribe
donde vale
y
Estructura electrónica: correcciones
[editar]En la sección anterior se consideraron las funciones de onda de un electrón ligado a un potencial central creado por un protón. Si bien dicho modelo explica cualitativamente el átomo de hidrógeno y con cierta aproximación las líneas espectrales, los datos experimentales revelan que dichas líneas son algo más complicadas, y el modelo anterior es sólo una simplificación razonable.
En un átomo real los niveles energéticos anteriores y la forma de las funciones de onda debe ser modificada para dar cuenta de la interacción entre el electrón y el protón es algo más complicada debido a efectos relativistas y la existencia del espín del electrón. Concretamente este último lleva tanto al acoplamiento entre espín y momento angular del electrón, como a la interacción entre el espín y el momento magnético del núcleo atómico. El hamiltoniano de un átomo de hidrógeno que tenga en cuenta todos estos efectos es más complicado que el Hamiltoniano que sólo incluye el potencial central, aunque numéricamente las energías de los estados ligados son similares:
Donde:
- , son el potencial y el potencial vector, si el campo magnético fuera nulo este último vector sería cero.
- , el campo magnético.
- , la masa reducida y el espín del electrón.
- , la constante de Planck racionalizada y la velocidad de la luz.
En concreto es necesario tener en cuenta en los cálculos:
- La interacción del espín electrónico con el campo magnético del núcleo atómico (tercer término)
- Los efectos relativistas debido a la variación de la masa aparente con la velocidad. (cuarto término)
- El término de Darwin, que no tiene un análogo clásico. (quinto término)
- La interacción espín-órbita. (sexto término)
Las correcciones que se desprenden de estos términos reciben el nombre de "estructura fina" de las líneas espectrales y experimentalmente aparecen como desdobles en líneas más finas de lo que aparentemente parecían con menor detalle líneas gruesas. El factor corrector debido a la corrección relativista y al término de Darwin lleva a que la energía de los niveles energéticos dependa no sólo del número cuántico principal , sino también del número cuántico siendo la expresión calculada para el caso de un átomo hidrogenoide:
Además posteriormente se descubrió que el efecto del momento magnético nuclear es desdoblar a su vez estas líneas en la llamada "estructura hiperfina" relacionada con el desplazamiento Lamb.
Un tratamiento similar al anterior y que da resultados similares es emplear el hamiltoniano relativista de Dirac:
Si se prescinde de la energía asociada a la masa en reposo del electrón estos niveles pueden resultan cercanos a los predichos por el hamiltoniano de Schrödinger, especialmente en el caso m = 0:
Estructura nuclear del átomo de hidrógeno
[editar]El hidrógeno posee tres isótopos conocidos:
El primero de ellos es el más abundante y es estable, tiene el núcleo atómico más simple posible formado por un único protón. El segundo isótopo se llama deuterio y tiene un núcleo formado por un protón y un neutrón, es un isótopo estable pero poco abundante en la naturaleza (sólo un 0,015 % de los átomos de hidrógeno son de deuterio). Finalmente el tercer isótopo, llamado tritio tiene un núcleo formado por dos neutrones y un protón. Debido al desequilibrio entre protones y neutrones, este átomo es inestable y se desintegra radiactivamente dando lugar a un átomo de helio, un electrón y un antineutrino electrónico:
Véase también
[editar]- Átomo hidrogenoide
- Ecuación diferencial
- Orbital atómico
- Operador nabla
- Operador nabla en coordenadas cilíndricas y esféricas
- Polinomios de Legendre
- Polinomios de Hermite
Referencias
[editar]Notas
[editar]Bibliografía
[editar]- Erwin Schrödinger; Mémoires sur la mécanique ondulatoire, Félix-Alcan (París-1933). Reedición Jacques Gabay (1988), ISBN 2-87647-048-9. Contiene la traducción al francés de Alexandre Proca de las memorias históricas de 1926:
- Cuantificación y valores propios (I) y (II), Annalen der Physik (4) 79 (1926) [[1] (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).] y [[2] (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).] (en alemán);
- Sobre la comparación entre la mecánica cuántica de Heisenberg-Born-Jordan y la mía, Annalen der Physik (4) 79 (1926) [[3]] (en alemán);
- Cuantificación y valores propios (III) - Teoría de las perturbaciones con aplicación del efecto Stark a las rayas de Balmer, Annalen der Physik (4) 80 (1926) [[4] (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).] (en alemán);
- Cuantificación y valores propios (IV), Annalen der Physik (4) 81 (1926) [[5] (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).] (en alemán);
- Sobre el efecto Compton, Annalen der Physik (4) 82(1927) [[6] (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).] (en alemán);
- El teorema de la conservación de la energía y la cantidad de movimiento para las ondas materiales, Annalen der Physik (4) 82 (1927) [[7] (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).] (en alemán);
- Intercambios de energía según la mecánica ondulatoria, Annalen der Physik (4) 83 (1927)[[8] (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).] (en alemán).
- Erwin Schrödinger, «An Undulatory Theory of the Mechanics of Atoms and Molecules», Phys. Rev. 28, 1049 (1926) [[9]] (en inglés)
- Jackson, J.D. Classical Electrodynamics, 3.ª ed., Wiley & Sons, 1999. pag. 103.
- Spiegel, Murray R.; Abellanas, Lorenzo (1992). McGraw-Hill, ed. Fórmulas y tablas de matemática aplicada. Aravaca (Madrid). ISBN 84-7615-197-7.
- Apuntes sobre polinomios de Laguerre de la Universidad de Chile
Enlaces externos
[editar]- A quick informal derivation of the Legendre polynomial in the context of the quantum mechanics of hydrogen
- Weisstein, Eric W. «Legendre polynomials». En Weisstein, Eric W, ed. MathWorld (en inglés). Wolfram Research.
- Dr James B. Calvert's article on Legendre polynomials from his personal collection of mathematics



















![{\displaystyle {\frac {1}{R(r)}}{\frac {\partial }{\partial r}}\left(r^{2}{\frac {\partial R(r)}{\partial r}}\right)\,-\,{\frac {2\mu r^{2}}{\hslash ^{2}}}(V(r)-E)\,=\,-{\frac {1}{Y(\theta ,\varphi )}}\left[{\frac {1}{\sin \theta }}{\frac {\partial }{\partial \theta }}\left(\sin \theta {\frac {\partial Y(\theta ,\varphi )}{\partial \theta }}\right)+{\frac {1}{\sin ^{2}\theta }}{\frac {\partial ^{2}Y(\theta ,\varphi )}{\partial \varphi ^{2}}}\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fbf45d47b630fa0ab1d929a935ab42dd218d6c8a)

































![{\displaystyle x{\frac {{\text{d}}^{2}}{{\text{d}}x^{2}}}S(x)+(1-2x+(2l+1)){\frac {\text{d}}{{\text{d}}x}}S(x)+2\left(\left[{\frac {\xi }{2}}+l\right]-(2l+1)\right)S(x)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a16e9bfb4fa5e31dd4c9b55f50a17b01665f9e13)















![{\displaystyle A_{nl}\,=\,\left({\frac {2}{na_{0}}}\right)^{3/2}\left[{\frac {(n-l-1)!}{2n[(n+l)!]}}\right]^{1/2}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/af5519b5450a6642cdc7938c76fb3032b8571410)














![{\displaystyle E_{n\ell }=\left[1+{\frac {Z^{2}\alpha ^{2}}{n}}\left(\delta _{0\ell }+{\frac {1}{\ell +1/2}}-{\frac {3}{4n}}\right)\right]E_{n}^{(0)}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/26acc6aff66f061c4a7fef917a8480cb46c58254)
![{\displaystyle {\hat {H}}={\hat {\alpha }}_{0}mc^{2}+\sum _{j=1}^{3}{\hat {\alpha }}_{j}\left[p_{j}-{\frac {e}{c}}A_{j}(\mathbf {x} ,t)\right]c+e\phi (\mathbf {x} ,t)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/de3252a47c78195c9448774d1255d1798799fcd5)

