Compuesto de organobromo

Los compuestos de organobromo o compuestos organobromados son compuestos orgánicos que contienen enlaces covalentes entre átomos de carbono y de bromo. El más generalizado es el bromometano pues se produce en la naturaleza. Una aplicación importante es el uso de éteres de difenilo polibromados como pirorretardantes. Una variedad de compuestos organobromados de escasa importancia se encuentran en la naturaleza, pero ninguno se biosintetizan o son necesarios para los mamíferos. Los compuestos organobromados están sometidos a mayor vigilancia por su impacto ambiental.
Propiedades generales
[editar]La mayoría de los compuestos organobromados, como la mayoría de los compuestos organohalogenados, son relativamente no-polares. El bromo es más electronegativo que el carbono (2,8 vs 2,5). En consecuencia, el carbono en un enlace carbono-bromo es electrofílico, es decir, los bromuros de alquilo son agentes alquilantes.
La fuerza de los enlaces carbono - halógeno se mide mediante las energías de disociación de enlace que valen respectivamente 115 kcal/mol (enlace carbono - flúor); 83,7 kcal/mol (carbono - cloro); 72,1 kcal/mol (carbono - bromo) y 57,6 kcal/mol (carbono - yodo)[1]
La reactividad de los compuestos organobromados se parece ser intermedia entre la reactividad de los compuestos organoclorados y de los de organoyodo. Para muchas aplicaciones, los compuestos de organobromo representan un compromiso de reactividad y coste. Las principales reacciones de los organobromados son la deshidrobromación, la reacción de Grignard, el acoplamiento reductivo y la sustitución nucleófila.
Métodos de síntesis
[editar]A partir de bromo
[editar]Los alquenos adicionan bromo fácilmente sin catalizadores para dar dibromuros vecinales (en átomos de carbono contiguos):
- RCH=CH2 + Br2 → RCHBrCH2Br
Los compuestos aromáticos experimentan bromación simultáneamente con la formación de bromuro de hidrógeno. Los detalles de la siguiente reacción siguen los patrones habituales de la sustitución aromática electrofílica:
- RC6H5 + Br2 → RC6H4Br + HBr
Una aplicación importante de esta reacción es la producción de tetrabromobisfenol-A a partir de bisfenol-A.
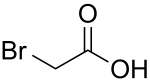
|
| Dos representaciones del ácido bromoacético |
La sustitución radicalaria de bromo se utiliza habitualmente para la preparación de compuestos organobromados. Los sustratos bencílicos o alílicos que contienen grupos carbonilo son especialmente propensos para estas reacciones. Por ejemplo, el ácido bromoacético, de gran importancia comercial, se genera directamente a partir de ácido acético y de bromo en presencia de tribromuro de fósforo como catalizador:
- CH3CO2H + Br2 → BrCH2CO2H + HBr
El bromo también convierte el fluoroformo en bromotrifluorometano.
A partir de bromuro de hidrógeno
[editar]El bromuro de hidrógeno se adiciona a los enlaces dobles para dar bromuros de alquilo, siguiendo la regla de Markovnikov:
- RCH=CH2 + HBr → RCHBrCH3
En presencia de radicales libres, la dirección de la adición se puede revertir. La adición radicalaria se utiliza comercialmente para la síntesis de 1-bromoalcanos, precursores de las aminas terciarias y las sales de amonio cuaternario. El bromuro de 2-feniletilo (C6H5CH2CH2Br) se produce a través de este método a partir del estireno.
El bromuro de hidrógeno también se puede utilizar para convertir los alcoholes en bromuros de alquilo. Esta reacción se emplea en la síntesis industrial del bromuro de alilo: v El bromuro de metilo, otro fumigante, se genera a partir de metanol y bromuro de hidrógeno.
A partir de sales de bromuro
[editar]Los iones bromuro Br-, presentes en sales como el bromuro de sodio, actúan como nucleófilos en la formación de compuestos organobromados en una reacción de desplazamiento.[2]
Compuestos organobromados de interés industrial
[editar]
Estructura de los tres compuestos organobromados industrialmente más significativos. De izquierda a derecha: Bromuro de etileno, ácido bromoacético y tetrabromobisfenol A.
Retardantes del fuego
[editar]Los compuestos Organobromados son ampliamente utilizados como retardantes del fuego.[3] El más significativo es el tetrabromobisfenol-A (4,4'-(1-metiletiliden)bis-(2,6-di-bromofenol, véase la imagen). Este compuesto y el anhídrido tetrabromoftálico son precursores de polímeros cuyo esqueleto está formado por enlaces covalentes bromo-carbono. Otros retardantes del fuego, como el hexabromociclododecano y los éteres de bromodifenilo, son aditivos y no se unen químicamente a los materiales que protegen. El uso de los pirorretardantes organobromados está creciendo, pero también es controvertido debido a que son contaminantes persistentes (COP).
Fumigantes y biocidas
[editar]El bromuro de etileno, que se obtiene mediante la adición de bromo al etileno, tuvo en su momento importancia comercial como componente de la gasolina con plomo. También fue un fumigante popular en la agricultura, desplazando al 1,2-dibromo-3-cloropropano ("DBCB"). Ambas aplicaciones están disminuyendo debido a consideraciones ambientales y de salud. El bromuro de metilo también es un fumigante eficaz, pero su producción y uso están controlados por el Protocolo de Montreal. Está creciendo el uso de biocidas organobromados utilizados en el tratamiento del agua. Agentes representativos son el bromoformo y dibromodimetilhidantoína ("DBDMH").[3]
Colorantes
[editar]Muchos tintes contienen enlaces carbono - bromo. El colorante de origen natural púrpura de Tiro (6,6'-dibromoíndigo) fue un colorante valioso antes del desarrollo de la industria de colorantes sintéticos en el siglo XIX. Varios derivados bromados de la antraquinona se utilizan comercialmente. El azul de bromotimol es un indicador de pH muy usado en química analítica.
Productos farmacéuticos
[editar]Entre los productos farmacéuticos organobromados comercialmente disponibles tenemos el vasodialator nicergolina, el sedante brotizolam, y el agente contra el cáncer pipobroman. Por otra parte, los compuestos organobromados rara vez son útiles farmacéuticamente, en contraste con la situación de los compuestos organofluorados. Se producen varios medicamentos como el bromuro de metilo (o sus equivalentes, las sales de bromhidrato), pero en tales casos el bromuro sirve como un contraión inocuo sin ningún significado biológico.[3]
Compuestos organobromados en la naturaleza
[editar]Los compuestos organobromados son los organohalogenuros más comunes en la naturaleza. A pesar de que la concentración de bromuro es sólo el 0,3% de la de cloruro en el agua de mar (300 veces menor), los compuestos organobromados son más frecuentes en los organismos marinos que los derivados organoclorados. Su abundancia refleja la fácil oxidación del ion bromuro hasta su equivalente Br+, un electrófilo potente. La enzima bromoperoxidasa cataliza esta reacción.[4] Se estima que son liberados en los océanos 1-2 millones de toneladas anuales de bromometano[5] Algunas algas comestibles contienen hasta un 80% en peso de bromoformo (CHBr3). Algunos de estos compuestos organobromados se emplean en una forma de "guerra química" interespecie. Sólo un compuesto organobromado se encuentra en los seres humanos[6]

Estructura de algunos compuestos naturales organobromados. De izquierda a derecha: bromoformo, bisfenol bromado, dibromoíndigo (Púrpura real), y tambjamina B que protege contra los depredadores.
Además de los tradicionales productos naturales bromados, una variedad de compuestos organobromados en la naturaleza son el resultado de la biodegradación de los retardantes bromados del fuego. Entre dichos metabolitos se incluyen los bromuros de arilo metoxilados e hidroxilados, así como los derivados bromados de las dioxinas. Estos compuestos se consideran contaminantes orgánicos persistentes (COPs) y se han encontrado en los mamíferos.
Seguridad
[editar]Los compuestos alquílicos de bromo a menudo son empleados como agentes alquilantes y los derivados aromáticos bromados están implicados entre los disruptores hormonales. Entre los compuestos comúnmente producidos, el dibromuro de etileno es de gran preocupación, ya que es altamente tóxico y altamente cancerígeno.
Véase también
[editar]Enlaces químicos del carbono con el resto de átomos
[editar]| CH | He | |||||||||||||||||
| CLi | CBe | CB | CC | CN | CO | CF | Ne | |||||||||||
| CNa | CMg | CAl | CSi | CP | CS | CCl | CAr | |||||||||||
| CK | CCa | CSc | CTi | CV | CCr | CMn | CFe | CCo | CNi | CCu | CZn | CGa | CGe | CAs | CSe | CBr | CKr | |
| CRb | CSr | CY | CZr | CNb | CMo | CTc | CRu | CRh | CPd | CAg | CCd | CIn | CSn | CSb | CTe | CI | CXe | |
| CCs | CBa | CHf | CTa | CW | CRe | COs | CIr | CPt | CAu | CHg | CTl | CPb | CBi | CPo | CAt | Rn | ||
| Fr | CRa | Rf | Db | CSg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||
| ↓ | ||||||||||||||||||
| CLa | CCe | CPr | CNd | CPm | CSm | CEu | CGd | CTb | CDy | CHo | CEr | CTm | CYb | CLu | ||||
| Ac | CTh | CPa | CU | CNp | CPu | CAm | CCm | CBk | CCf | CEs | Fm | Md | No | Lr | ||||
| Química orgánica básica. | Muchos usos en Química. |
| Investigación académica, pero no un amplio uso. |
Enlace desconocido / no evaluado. |
Referencias
[editar]- ↑ Blanksby SJ, Ellison GB (abril de 2003). «Bond dissociation energies of organic molecules». Acc. Chem. Res. 36 (4): 255-63. PMID 12693923. doi:10.1021/ar020230d.
- ↑ James S. Nowick, Guido Lutterbach, “Sodium Bromide” in Encyclopedia of Reagents for Organic Synthesis John Wiley & Sons, 2001. doi 10.1002/047084289X.rs054
- ↑ a b c David Ioffe, Arieh Kampf “Bromine, Organic Compounds” in Kirk-Othmer Encyclopedia of Chemical Technology 2002 by John Wiley & Sons. doi 10.1002/0471238961.0218151325150606.a01 10.1002/0471238961.0218151325150606.a01.
- ↑ Jayme N. Carter-Franklin, Alison Butler “Vanadium Bromoperoxidase-Catalyzed Biosynthesis of Halogenated Marine Natural Products” Journal of the American Chemical Society 2004, volume 126, 15060-15066. doi 10.1021/ja047925p
- ↑ Gordon W. Gribble “The diversity of naturally occurring organobromine compounds” Chemical Society Reviews, 1999, volume 28, pages 335 – 346.doi 10.1039/a900201d
- ↑ Gordon W. Gribble (1998). «Naturally Occurring Organohalogen Compounds». Acc. Chem. Res. 31 (3): 141-152. doi:10.1021/ar9701777.



