Exocitosis
| Transporte de membrana | ||
|---|---|---|
| Mecanismos de transporte químico a través de membranas biológicas | ||
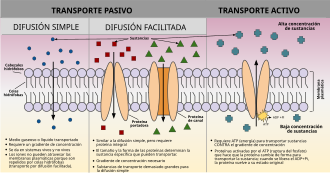 | ||
| Transporte pasivo |
| |
| Transporte activo | ||
| Citosis | ||
| Endocitosis | ||
| Exocitosis |
| |
| Otras formas de transporte anexas son: el Transporte paracelular y el Transporte transcelular. Su movimiento opuesto se conoce como Transporte inverso. | ||
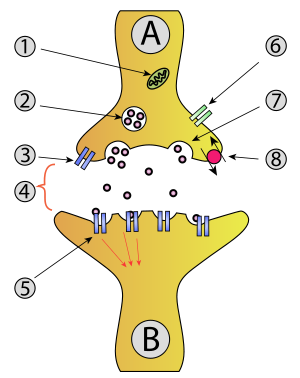
1. Mitocondria,
2. Vesícula sináptica con neurotransmisores,
3. Autoreceptor,
4. Sinapsis con neurotransmisor liberado (serotonina),
5. Receptores postsinápticos activados por neurotransmisores (inducción de un potencial postsináptico),
6. Canal de calcio,
7. Exocitosis de una vesícula y
8. Neurotransmisor recapturado
La exocitosis (del griego ἔξω exo: fuera y κύτος cito: receptáculo) es una forma de transporte activo y transporte por arrastre en el que una célula transporta moléculas (por ejemplo, neurotransmisores y proteínas) fuera de la célula (exo- + citosis). Como mecanismo de transporte activo, la exocitosis requiere el uso de energía para transportar material. Todas las células utilizan la exocitosis y su contraparte, la endocitosis, porque la mayoría de las sustancias importantes para ellas son moléculas polares grandes, que no pueden atravesar la porción hidrofóbica de la membrana celular mediante el transporte pasivo. La exocitosis es el proceso por el cual se libera de una vez, una gran cantidad de moléculas diferentes, y se denomina carga a granel. La exocitosis ocurre a través de portales en la membrana plasmática celular llamados porosomas que son una estructura de lipoproteína en forma de copa en la membrana plasmática, donde las vesículas secretoras se acoplan y fusionan transitoriamente para liberar su contenido intravesicular.
En la exocitosis, las vesículas secretoras unidas a la membrana se transportan a la membrana celular, donde se acoplan y fusionan en los porosomas y su contenido (es decir, moléculas solubles en agua) se secreta al entorno extracelular. Esta secreción es posible porque la vesícula se fusiona transitoriamente con la membrana plasmática. En el contexto de la neurotransmisión, los neurotransmisores normalmente se liberan desde las vesículas sinápticas hacia la hendidura sináptica a través de la exocitosis; sin embargo, los neurotransmisores también pueden liberarse mediante transporte inverso a través de proteínas de transporte de membrana.
La exocitosis también es un mecanismo por el cual las células pueden insertar proteínas de membrana (como canales iónicos y receptores de superficie celular), lípidos y otros componentes en la membrana celular. Las vesículas que contienen estos componentes de la membrana se fusionan por completo y se convierten en parte de la membrana celular externa.
Historia
El término fue propuesto por Christian de Duve en 1963.[1]
Tipos

En eucariotas hay dos tipos de exocitosis: uno es la exocitosis no constitutiva desencadenada por Ca2+ (es decir, exocitosis regulada) y el otro tipo es la exocitosis constitutiva no desencadenada por Ca2+ (es decir, no regulada). La exocitosis vesicular en bacterias procariotas gram negativas es un tercer mecanismo y el último hallazgo en exocitosis.
La exocitosis no constitutiva desencadenada por Ca2+ requiere una señal externa, una señal de clasificación específica en las vesículas, una capa de clatrina, así como un aumento del calcio intracelular. En los organismos multicelulares, este mecanismo inicia muchas formas de comunicación intercelular, como la transmisión sináptica, la secreción de hormonas por parte de las células neuroendocrinas y la secreción de células inmunitarias. En las neuronas y las células endocrinas, las proteínas SNARE y las proteínas SM catalizan la fusión formando un complejo que une las dos membranas de fusión. Por ejemplo, en las sinapsis, el complejo SNARE está formado por sintaxina-1 y SNAP25 en la membrana plasmática y VAMP2 en la membrana vesicular.[2] La exocitosis en las sinapsis químicas neuronales se desencadena por Ca2+ y sirve para la señalización interneuronal. Los sensores de calcio que desencadenan la exocitosis podrían interactuar con el complejo SNARE o con los fosfolípidos de las membranas de fusión. La sinaptotagmina ha sido reconocida como el sensor principal para la exocitosis desencadenada por Ca2+ en animales.[3] Sin embargo, las proteínas sinaptotagmina están ausentes en plantas y eucariotas unicelulares. Otros posibles sensores de calcio para la exocitosis son proteínas de mano EF (por ejemplo, calmodulina) y dominio C2 (por ejemplo, Ferlins, E-synaptotagmin, Doc2b) que contienen proteínas. No está claro cómo los diferentes sensores de calcio pueden cooperar juntos y mediar en la cinética de exocitosis desencadenada por calcio de una manera específica.[4]
La exocitosis constitutiva es realizada por todas las células y sirve para la liberación de componentes de la matriz extracelular o el suministro de proteínas de membrana recién sintetizadas que se incorporan a la membrana plasmática después de la fusión de la vesícula de transporte. No existe un consenso claro sobre la maquinaria y los procesos moleculares que impulsan la formación, gemación, translocación y fusión de las vesículas post-Golgi a la membrana plasmática. La fusión implica el anclaje de la membrana (reconocimiento) y la fusión de la membrana. Todavía no está claro si la maquinaria entre la secreción constitutiva y regulada es diferente. La maquinaria necesaria para la exocitosis constitutiva no se ha estudiado tanto como el mecanismo de exocitosis regulada. Dos complejos de anclaje están asociados con exocitosis constitutiva en mamíferos, ELKS y Exocyst. ELKS es una proteína enrollada en espiral grande, también implicada en la exocitosis sináptica, que marca los puntos de fusión de los "puntos calientes" de la fusión de los transportadores secretores. El exoquiste es un complejo proteico octamérico. En los mamíferos, los componentes del exoquiste se localizan tanto en la membrana plasmática como en el aparato de Golgi y las proteínas del exoquiste se colocalizan en el punto de fusión de las vesículas posteriores al Golgi. La fusión de membrana de la exocitosis constitutiva, probablemente, está mediada por SNAP29 y Syntaxin19 en la membrana plasmática y YKT6 o VAMP3 en la membrana de la vesícula.[5]
La exocitosis vesicular se produce en bacterias procariotas gram negativas. El periplasma se pellizca como vesículas de la membrana externa bacteriana (OMV) para translocar señales bioquímicas microbianas en células huésped eucariotas[6] u otros microbios ubicados cerca,[7] logrando el control del microbio secretor en su entorno, incluida la invasión del huésped, endotoxemia, compitiendo con otros microbios por la nutrición, etc. Este hallazgo de tráfico de vesículas de membrana que ocurre en la interfaz huésped-patógeno también disipa el mito de que la exocitosis es puramente un fenómeno de células eucariotas.[8]
Pasos

Cinco pasos están involucrados en la exocitosis:
Tránsito de vesículas
Ciertos pasos de tránsito de vesículas requieren el transporte de una vesícula sobre una distancia moderadamente pequeña. Por ejemplo, es probable que las vesículas que transportan proteínas desde el aparato de Golgi al área de la superficie celular utilicen proteínas motoras y una pista del citoesqueleto para acercarse a su objetivo. Antes de que el anclaje hubiera sido apropiado, muchas de las proteínas utilizadas para el transporte activo se habrían configurado para el transporte pasivo, porque el aparato de Golgi no requiere ATP para transportar proteínas. Tanto la base de actina como la base de microtúbulos están implicadas en estos procesos, junto con varias proteínas motoras. Una vez que las vesículas alcanzan sus objetivos, entran en contacto con factores de anclaje que pueden restringirlas.
Anclaje de vesículas
Es útil distinguir entre la atadura suelta inicial de las vesículas a su objetivo de las interacciones de empaquetamiento más estables. El anclaje implica enlaces a distancias de más de la mitad del diámetro de una vesícula desde una superficie de membrana dada (>25 nm). Es probable que las interacciones de anclaje participen en la concentración de vesículas sinápticas en la sinapsis.
Acoplamiento de vesículas
Las vesículas secretoras se acoplan transitoriamente y se fusionan en el porosoma de la membrana plasmática celular, a través de un complejo de anillo t-/v-SNARE apretado.
Cebado de vesículas
En la exocitosis neuronal, el término cebado se ha utilizado para incluir todos los reordenamientos moleculares y las modificaciones de proteínas y lípidos dependientes de ATP que tienen lugar después del acoplamiento inicial de una vesícula sináptica, pero antes de la exocitosis, de modo que la entrada de iones de calcio es todo lo necesario para desencadenar la liberación casi instantánea de neurotransmisores. En otros tipos de células, cuya secreción es constitutiva (es decir, continua, independiente de iones de calcio, no desencadenada) no hay cebado.
Fusión de vesículas

La fusión transitoria de vesículas está impulsada por las proteínas SNARE, lo que da como resultado la liberación del contenido de las vesículas en el espacio extracelular (o en el caso de las neuronas en la hendidura sináptica).
La fusión de las membranas donante y aceptora cumple tres tareas:
- La superficie de la membrana plasmática aumenta (por la superficie de la vesícula fusionada). Esto es importante para la regulación del tamaño celular, por ejemplo, durante el crecimiento celular.
- Las sustancias dentro de la vesícula se liberan al exterior. Estos pueden ser productos de desecho o toxinas, o moléculas de señalización como hormonas o neurotransmisores durante la transmisión sináptica.
- Las proteínas incrustadas en la membrana de la vesícula ahora forman parte de la membrana plasmática. El lado de la proteína que miraba hacia el interior de la vesícula ahora mira hacia el exterior de la célula. Este mecanismo es importante para la regulación de transmembrana y transportadores.
Recuperación de vesículas
La recuperación de vesículas sinápticas ocurre por endocitosis. La mayoría de las vesículas sinápticas se reciclan sin una fusión completa en la membrana (fusión kiss-and-run) a través del porosoma. La exocitosis no constitutiva y la endocitosis posterior son procesos que consumen mucha energía y, por lo tanto, dependen de las mitocondrias.[10]
El examen de las células después de la secreción usando microscopía electrónica demuestra una mayor presencia de vesículas parcialmente vacías después de la secreción. Esto sugirió que durante el proceso secretor, solo una parte del contenido vesicular puede salir de la célula. Esto solo podría ser posible si la vesícula estableciera temporalmente una continuidad con la membrana plasmática celular en los porosomas, expulsara una parte de su contenido, luego se separara, se volviera a sellar y se retirara al citosol (endocitosa). De esta forma, la vesícula secretora podría reutilizarse para posteriores rondas de exoendocitosis, hasta quedar completamente vacía de su contenido.[11]
Véase también
- Endocitosis
- Pinocitosis
- Fagocitosis
- Nanotubo de membrana
- Diseminación viral
- Zona activa presináptica
- Cuerpo residual
- Desgranulación
Referencias
- ↑ Michaelis, A.; Green, M. M. (1991). Glossary of Genetics : Classical and Molecular (Fifth edition edición). Springer Berlin Heidelberg. ISBN 978-3-642-75333-6. OCLC 840295988.
- ↑ Shin, O. H. (17 de enero de 2011). Terjung, Ronald, ed. Comprehensive Physiology (en inglés) 4 (1 edición). Wiley. pp. 149-175. ISBN 978-0-470-65071-4. doi:10.1002/cphy.c130021.
- ↑ Wolfes, Anne C; Dean, Camin (August 2020). «The diversity of synaptotagmin isoforms». Current Opinion in Neurobiology (en inglés) 63: 198-209. PMID 32663762. doi:10.1016/j.conb.2020.04.006.
- ↑ Pang, Zhiping P; Südhof, Thomas C (August 2010). «Cell biology of Ca2+-triggered exocytosis». Current Opinion in Cell Biology (en inglés) 22 (4): 496-505. PMC 2963628. PMID 20561775. doi:10.1016/j.ceb.2010.05.001.
- ↑ Stalder, Danièle; Gershlick, David C. (November 2020). «Direct trafficking pathways from the Golgi apparatus to the plasma membrane». Seminars in Cell & Developmental Biology (en inglés) 107: 112-125. PMC 7152905. PMID 32317144. doi:10.1016/j.semcdb.2020.04.001.
- ↑ YashRoy R C (1993) Electron microscope studies of surface pili and vesicles of Salmonella 3,10:r:- organisms.
- ↑ Kadurugamuwa, J L; Beveridge, T J (1996). «Bacteriolytic effect of membrane vesicles from Pseudomonas aeruginosa on other bacterial including pathogens: conceptually new antibiotics». Journal of Bacteriology 178 (10): 2767-2774. PMC 178010. PMID 8631663. doi:10.1128/jb.178.10.2767-2774.1996.
- ↑ YashRoy, R.C. (1998). «Discovery of vesicular exocytosis in procaryotes and its role in Salmonella invasion». Current Science 75 (10): 1062-1066.
- ↑ Georgiev, Danko D .; James F . Glazebrook (2007). «Subneuronal processing of information by solitary waves and stochastic processes». En Lyshevski, Sergey Edward, ed. Nano and Molecular Electronics Handbook. Nano and Microengineering Series. CRC Press. pp. 17-1-17-41. ISBN 978-0-8493-8528-5. doi:10.1201/9781315221670-17.
- ↑ Ivannikov, M. (2013). «Synaptic vesicle exocytosis in hippocampal synaptosomes correlates directly with total mitochondrial volume». J. Mol. Neurosci. 49 (1): 223-230. PMC 3488359. PMID 22772899. doi:10.1007/s12031-012-9848-8.
- ↑ Boron, WF; Boulpaep, EL (2012), Medical Physiology. A Cellular and Molecular Approach 2, Philadelphia: Elsevier.
Enlaces externos
- Esta obra contiene una traducción parcial derivada de «Exocytosis» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.
- MeSH: Exocytosis (en inglés)
