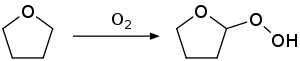Tetrahidrofurano
| Tetrahidrofurano | |
|---|---|

| |
| |
| Nombre IUPAC | Tetrahidrofurano (u oxolano) |
| Otros nombres | THF, oxaciclopentano, óxido de dietileno, óxido de tetrametileno |
| Fórmula empírica | C4H8O |
| Masa molecular | 72,11 g/mol |
| Estado físico/Color | Líquido/Incoloro |
| Número CAS | 109-99-9 |
| Propiedades | |
| Densidad | 0,89 g/cm³ a 20 °C |
| Punto de fusión | -108,5 °C (164,6 K) |
| Punto de ebullición | 66 °C (339 K) |
| Solubilidad en agua | Miscible a 20 °C |
| Información de Seguridad | |
 
| |
| Frases R: R11, R19, R36/37
Frases S: S16,S29,S33 | |
| Exenciones y Referencias[1][2] | |
El tetrahidrofurano es un compuesto orgánico heterocíclico. No confundir con tetrahidrofolato (a veces escrito como H4folato o THF). Es un líquido transparente, de baja viscosidad y con un olor parecido al del dietil éter (a "éter"). Es uno de los éteres más polares y se usa como solvente de polaridad intermedia en reacciones químicas. El THF es un solvente dipolar aprótico protofílico (capaz de aceptar protones, dados los pares de electrones no compartidos del átomo de oxígeno que le dan características de base de Lewis), con una constante dieléctrica de 7,6 (a 25 °C). El THF es el análogo completamente hidrogenado del compuesto aromático furano.
Obtención
[editar]Se obtiene por hidrogenación del furano o por deshidratación intramolecular del 1,4-butanodiol.
Aplicaciones
[editar]El THF es un disolvente aprótico, moderadamente polar. Es capaz de disolver un amplio rango de compuestos.
El dietil éter puede ser a menudo sustituido por THF, especialmente cuando se requiere un mayor punto de ebullición. Así pues, el THF, como el dietil éter, es usado a menudo en hidroboraciones de alquenos. Ambos éteres tienen un átomo de oxígeno que puede coordinarse a un átomo de boro electrodeficiente, formando un aducto ácido-base de Lewis. De forma similar, el THF o el dietil éter son utilizados habitualmente como disolventes para reactivos de Grignard debido a la habilidad del átomo de oxígeno de coordinarse con el átomo de magnesio del reactivo de Grignard (estabilizándolo). Actualmente el THF puede ser remplazado en reacciones organometálicas, por el 2-metiltetrahidrofurano(un disolvente neotérico de origen renovable y benigno con el medio ambiente) obteniéndose mejores resultados para las reacciones de Grignard con reactivos bencílicos o arílicos.
El THF es a menudo usado en la ciencia de polímeros. Por ejemplo, puede ser usado para disolver el caucho antes de determinar su masa molecular mediante cromatografía de exclusión por tamaño.
El THF se usa ampliamente a nivel industrial como disolvente de resinas y plásticos en tintes, pinturas, barnices, pegamentos y recubrimientos, y en la industria alimentaria en la fabricación de envases para alimentos.
Precauciones
[editar]El THF tiende a formar peróxidos durante su almacenaje. Como resultado de esto el THF no debería ser destilado a sequedad, ya que puede dejar un residuo altamente explosivo de peróxidos. El THF comercial es por tanto habitualmente estabilizado con BHT. Se almacena en recipientes herméticamente cerrados y protegido de la luz.
Referencias
[editar]- ↑ «Fichas internacionales de seguridad química (FISQ)». Archivado desde el original el 18 de diciembre de 2008. Consultado el 30 de octubre de 2008.
- ↑ Fichas de datos de seguridad (FDS)
Bibliografía
[editar]- K. Peter C. Vollhardt (1994). Química Orgánica. Barcelona: Ediciones Omega S.A. ISBN 84-282-0882-4.
- W.R. Peterson (1996). Formulación y nomenclatura química orgánica. Barcelona: EDUNSA - Ediciones y distribuciones universitarias S.A. ISBN 84-85257-03-0.