Ácido oxaloacético
| Ácido oxaloacético | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
|
Ácido oxobutanodioico Ácido 2-ceto-1,4-butanodioico | ||
| General | ||
| Otros nombres |
Ácido oxaloacético Ácido oxalacético Oxaloacetato | |
| Fórmula estructural |
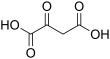 | |
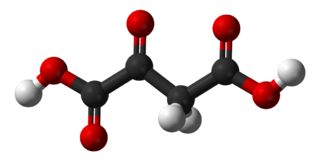
| Fórmula molecular | C4H4O5 | |
| Identificadores | ||
| Número CAS | 328-42-7[1] | |
| ChEBI | 30744 | |
| ChEMBL | CHEMBL1794791 | |
| ChemSpider | 945 | |
| PubChem | 970 | |
| UNII | 2F399MM81J | |
| KEGG | C00036 | |
|
O=C(O)C(=O)CC(=O)O
| ||
| Propiedades físicas | ||
| Densidad | 180 kg/m³; 0,18 g/cm³ | |
| Masa molar | 13 207 g/mol | |
| Punto de fusión | 161 °C (434 K) | |
| Propiedades químicas | ||
| Acidez |
1: 2,22 pKa 2: 3,89 pKa | |
| Termoquímica | ||
| ΔfH0sólido | -943,21 kJ/mol | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El ácido oxalacético o su forma ionizada, el oxalacetato, es un importante metabolito intermediario en múltiples rutas metabólicas, entre ellas el ciclo de Krebs (ciclo del ácido cítrico o ciclo de los ácidos tricarboxílicos), la gluconeogénesis, el ciclo de la urea, la síntesis de aminoácidos, la biosíntesis de ácidos grasos, el ciclo del glioxilato,[2] y la fotosíntesis C-4.
Síntesis[editar]
Se puede sintetizar por dos reacciones anapleróticas.
- Al pasar el piruvato a oxalacetato por carboxilación.
- Al pasar el aspartato a oxalacetato por transaminación.
Enoles[editar]
El ácido oxaloacético atraviesa sucesivas desprotonaciones para dar el dianión:
- HO2CC(O)CH2CO2H −O2CC(O)CH2CO2H + H+ pKa = 2.22
- −O2CC(O)CH2CO2H −O2CC(O)CH2CO2− + H+, pKa = 3.89
A un pH alto (alcalino), el protón enolizable se ioniza:
- −O2CC(O)CH2CO2− −O2CC(O−)CHCO2− + H+, pKa = 13.03
Las formas enólicas del ácido oxaloacético son particularmente estables, tanto es así que los dos tautómeros tienen diferentes puntos de fusión (152 °C para la forma cis y 184 °C para la forma trans).
Biosíntesis[editar]
El oxaloacetato se forma de distintas maneras en la naturaleza. Una de las rutas principales de síntesis es la oxidación de L-malato, catalizado por el enzima malato deshidrogenasa, en el ciclo de Krebs. El malato es también oxidado por el succinato deshidrogenasa en una reacción lenta con el enol-oxalacetato como producto de partida.[3]
Una segunda vía de síntesis consiste en la transaminación o deaminación de aspartato.
Otra vía de síntesis procede de la condensación de piruvato con ácido carbónico, con hidrólisis de ATP:
- CH3C(O)CO2− + HCO3− + ATP → −O2CCH2C(O)CO2− + ADP + Pi
Esto ocurre en el mesófilo de las hojas de las plantas, este proceso se transforma en fosfoenolpiruvato, catalizado por el enzima piruvato carboxilasa.
Véase también[editar]
- Ciclo de Krebs
- Gluconeogénesis
- Ciclo de la urea
- Biosíntesis de ácidos grasos
- Ciclo del glioxilato
- Fotosíntesis C-4.
Referencias[editar]
- ↑ Número CAS
- ↑ Nelson, David L.; Cox, Michael M. (2005), Principles of Biochemistry (4th ed.), New York: W. H. Freeman, ISBN 0-7167-4339-6
- ↑ M.V. Panchenko and A.D. Vinogradov (1991). «Direct demonstration of enol-oxaloacetate as an immediate product of malate oxidation by the mammalian succinate dehydrogenase». FEBS letters 286 (1-2): 76-78. doi:10.1016/0014-5793(91)80944-X.

