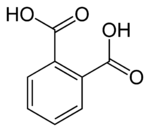
Ácido ftálico
| Ácido ftálico | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| ácido benceno-1,2-dicarboxílico | ||
| General | ||
| Otros nombres | ácido ftálico, ácido benzeno-1,2-dioico | |
| Fórmula molecular | C8H6O4 | |
| Identificadores | ||
| Número CAS | 88-99-3[1] | |
| ChEMBL | CHEMBL1045 | |
| KEGG | C01606 | |
| Propiedades físicas | ||
| Apariencia | blanco | |
| Densidad | 1593 kg/m³; 1593 g/cm³ | |
| Masa molar | 16 614 g/mol | |
| Propiedades químicas | ||
| Acidez | 2,98, 5,28[2] pKa | |
| Solubilidad en agua | 0,6[3][4] | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El ácido ftálico (C6H4(CO2H)2) es una sustancia incolora, soluble en agua y en alcohol. Tiene un sistema fenílico con dos grupos carboxi en posición 1 y 2. Su pKa1=2,89 y pKa2=5,50. Su nombre deriva del naftaleno del cual se generaba antiguamente por oxidación. Hoy en día la síntesis se basa en la oxidación del o-xileno.
El ácido ftálico se produce por la oxidación catalítica del naftaleno o del ortho-xileno directamente en anhídrido ftálico y una posterior hidrólisis del anhídrido.[5]
Historia
El ácido ftálico se obtuvo por primera vez por el químico francés Auguste Laurent en 1836 mediante la oxidación de tetracloruro de naftaleno. Creyendo que la sustancia que resultó era un derivado del naftaleno, lo llamó "ácido naftalico".[6] Después de que el químico suizo Jean Charles Galissard de Marignac determinase su fórmula correcta,[7] Laurent le dio su actual nombre.[8] Los métodos de fabricación en el siglo XIX fueron mediante la oxidación de tetracloruro de naftaleno con ácido nítrico, o, mejor, la oxidación del hidrocarburo con ácido sulfúrico fumante, usando mercurio o el sulfato de mercurio (II) como catalizador.
Usos
Aunque el ácido ftálico es de modesta importancia comercial, está estrechamente relacionado con el derivado de anhídrido ftálico, que es un producto químico producido a gran escala, ya que es un compuesto de partida importante en numerosas síntesis orgánicos, sobre todo de colorantes del grupo trifenilmetilo. Así por su reacción con el fenol en presencia de cloruro de zinc como ácido de Lewis y reactivo higroscópico se obtiene la fenolftaleína, con el resorcinol la fluoresceina, etc.
Los ésteres del ácido ftálico con alcoholes alifáticos de cadena larga se utilizan para modificar las propiedades mecánicas de unos plásticos como el policloruro de vinilo (PVC). Hay sospechas que son neurotóxicas y podrían ser cancerígenas.
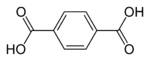
El ácido isoftálico se emplea en la síntesis de unas resinas de poliéster; mientras que el ácido tereftálico es, entre otras aplicaciones, la base del polietilentereftalato (PET), plástico empleado por ejemplo en la fabricación de envases de bebidas. Estos isómeros se generan igualmente a partir de los xilenos correspondientes.
La sal monopotásica: ftalato ácido de potasio es un ácido estándar en química analítica, que se usa como patrón primario para estandarizar bases.
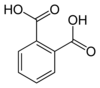
Isómeros
El ácido ftálico tiene dos isómeros, el ácido isoftálico con los grupos carboxi en posición 1 y 3 y el ácido tereftálico con los grupos en posición 1 y 4 sobre el anillo del benceno.
|

|
|
| ácido ftálico | ácido isoftálico | ácido tereftálico |
| (ácido orto-ftálico) | (ácido meta-ftálico) | (ácido para-ftálico) |
Enlaces externos
 Wikimedia Commons alberga una galería multimedia sobre Ácido ftálico.
Wikimedia Commons alberga una galería multimedia sobre Ácido ftálico.
- ↑ Número CAS
- ↑ Brown, H.C., et al., in Baude, E.A. and Nachod, F.C., Determination of Organic Structures by Physical Methods, Academic Press, New York, 1955.
- ↑ http://hazard.com/msds/mf/baker/baker/files/p4270.htm
- ↑ http://actrav.itcilo.org/actrav-english/telearn/osh/ic/88993.htm
- ↑ Peter M. Lorz, Friedrich K. Towae, Walter Enke, Rudolf Jäckh, Naresh Bhargava, Wolfgang Hillesheim "Phthalic Acid and Derivatives" in Ullmann's Encyclopedia of Industrial Chemistry, 2007, Wiley-VCH, Weinheim. doi 10.1002/14356007.a20_181.pub2
- ↑ Ver:
- Auguste Laurent (1836) "Sur l'acide naphtalique et ses combinaisons" [Sobre el ácido natlálico y sus componentes], Annales de Chimie et de Physique, 61 : 113-125. (Nota: las fórmulas empíricas de los compuestos que se analizaron en ese artículo eran incorrectos, en parte debido a que, durante ese período, los químicos utilizaban masas atómicas incorrectas del carbono (6 en lugar de 12) y de otros elementos.)
- Reimpreso en alemán como: Auguste Laurent (1836) "Ueber Naphthalinsäure und ihre Verbindungen" (On naphthalenic acid and its compounds), Annalen der Pharmacie, 19 (1) : 38-50; para la preparación del ácido ftálico, ver página 41.
- ↑ C. de Marignac (1841) "Ueber die Naphtalinsäure und ein bei ihrer Darstellung entstehendes flüchtiges Produkt" ("Sobre el ácido naftalinico y un producto volátil que surge durante su preparación"), Annalen der Chemie und Pharmacie, 38 (1) : 13-20. (Note: Again, Marignac's empirical formulae are wrong because chemists at this time used incorrect atomic masses.)
- ↑ Ver:
- Auguste Laurent (1841) "Sur de nouvelles combinaisons nitrogénées de la naphtaline et sur les acides phtalique et nitrophtalique" (On new nitrogenous compounds of naphthalene, and on phthalic acid and nitrophthalic acid), Revue Scientifique et Industrielle, 6 : 76-99; en la página 92, Laurent coins the name "acide phtalique" (phthalic acid) and admits that his earlier empirical formula for phthalic acid was wrong.
- Reimpreso en alemán como: Auguste Laurent (1842) "Ueber neue stickstoffhaltige Verbindungen des Naphtalins, über Phtalinsäure und Nitrophtalinsäure" (On new nitrogenous compounds of naphthalene, on phthalic acid and nitrophthalic acid), Annalen der Chemie und Pharmacie, 41 (1) : 98-114; on page 108, Laurent coins the name "Phtalinsäure" (phthalic acid).
