Umbeliferona
| Umbeliferona | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| 7-Hydroxychromen-2-one | ||
| General | ||
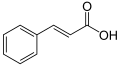
| Fórmula estructural |
| |
| Fórmula molecular | C9H6O3 | |
| Identificadores | ||
| Número CAS | 93-35-6[1] | |
| ChEBI | 27510 | |
| ChEMBL | 51628 | |
| ChemSpider | 4444774 | |
| PubChem | 5281426 | |
| UNII | 60Z60NTL4G | |
| KEGG | C09315 | |
| Propiedades físicas | ||
| Masa molar | 162,031694 g/mol | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Umbelliferona, también llamado 7-hydroxycoumarina, hydrangina, skimmetina, y beta-umbelliferona, es un producto natural generalizado de la familia de la cumarina.
Absorbe fuertemente la radiación ultravioleta en varias longitudes de onda. A pesar de varias indicaciones de que este producto químico es fotomutagénico, se utiliza en filtros solares.[2] La umbeliferona se ha informado que tiene propiedades antioxidantes.[3]
Es un sólido cristalino de color blanco amarillento que tiene una ligera solubilidad en agua caliente, pero de alta solubilidad en etanol.
Producción natural
Umbeliferona se produce en muchas plantas conocidas de la familia Apiaceae (umbelíferas), tales como la zanahoria, cilantro y angélica de jardín, así como en plantas de otras familias, tales como Hieracium pilosella, Asteraceae o la hoja ancha hortensia ( Hydrangea macrophylla, Hydrangeaceae, bajo el nombre hydrangina).
Es uno de los componentes de la asafétida, el látex seco del hinojo gigante ( Ferula communis ). También se encuentra en Justicia pectoralis (Acanthaceae).[4][5]
Biosíntesis
Umbeliferona es un fenilpropanoide y, como tal, se sintetiza a partir de L-fenilalanina, que a su vez se produce a través de la vía de shikimato. La fenilalanina se transforma en ácido cinámico , seguido por hidroxilación por cinamato 4-hidroxilasa para producir ácido 4-cumárico . El ácido 4-cumárico es de nuevo hidroxilado por cinamato / cumarato 2-hidroxilasa para producir ácido 2,4-dihidroxi-cinámico ( ácido umbelico ) seguido de una rotación de unión del enlace insaturado adyacente al grupo ácido carboxílico. Por último un ataque intramolecular del grupo hidroxilo de C2 'para el grupo de ácido carboxílico se cierra el anillo y forma la lactona umbeliferona.
Síntesis química
Umbelliferone es tradicionalmente sintetizada usando la Condensación de Pechmann, del resorcinol y fácido formil (generado del ácido malico in situ).
Una síntesis más reciente utiliza propiolato de metilo y un catalizador de paladio.
Fluorescencia ultravioleta
Umbeliferona absorbe fuertemente a 300, 305 y 325 nm, con registro de absortividad de valores de 3,9, 3,95 y 4,15, respectivamente, y emite fluorescencia azul en los rayos ultravioleta y luz visible. La potente absorción de tres longitudes de onda diferentes, junto con el hecho de que la energía se disipa de manera segura como la luz visible, hace a la umbeliferona un agente de filtro solar útil. Los cambios en la absorción en solución alcalina, desde el grupo fenólico hidroxilo se desprotonan (pKa = 7.7).
Usos
La actividad ultravioleta de 'umbeliferona la llevó a su uso como un agente protector solar y un abrillantador óptico para los textiles. También se ha utilizado como un medio activo para los láseres de colorante . Umbeliferona se puede utilizar como un indicador de fluorescencia de iones metálicos tales como cobre y calcio. Actúa como un indicador de pH en el rango de 6.5 a 8.9.
Derivados de umbelliferona
Umbeliferona es el compuesto de origen de un gran número de productos naturales. Herniarina (7 - O -metilumbeliferona o 7-metoxicumarina) se produce en las hojas de cáñamo agua ( Eupatorium ayapana ) y Herniaria. O derivados glicosilados, tales como skimmin (7 - O -β- D -glucopyranosylumbelliferone) se producen naturalmente y se utilizan para la fluorimétrica determinación de enzimas de glucosidasas. Los derivados de isopreno también están muy extendidos, tales como marmin (que se encuentra en la piel del pomelo y en la corteza de Aegle marmelos) y furanocumarinas tales como marmesin, angelicina, y psoraleno.
Umbelliferone 7-apiosylglucoside puede ser aislado de la raíz de Gmelina arborea.[6]
Véase también
Referencias
- ↑ Número CAS
- ↑ cancerweb
- ↑ «UMBELLIFERONE». www.chemicalland21.com. Consultado el 21 de noviembre de 2011.
- ↑ Leal, L. K. A. M.; A. A. G. Ferreira, G. A. Bezerra, F. J. A. Matos, G. S. B. Viana (2000-05). «Antinociceptive, anti-inflammatory and bronchodilator activities of Brazilian medicinal plants containing coumarin: a comparative study». Journal of Ethnopharmacology 70 (2): 151-159. ISSN 0378-8741. PMID 10771205. doi:10.1016/S0378-8741(99)00165-8. Parámetro desconocido
|fechaaceso=ignorado (se sugiere|fechaacceso=) (ayuda); - ↑ Lino, C. S.; M. L. Taveira, G. S. B. Viana, F. J. A. Matos (1997). «Analgesic and antiinflammatory activities of Justicia pectoralis Jacq and its main constituents: coumarin and umbelliferone». Phytotherapy Research 11 (3): 211-215. doi:10.1002/(SICI)1099-1573(199705)11:3<211::AID-PTR72>3.0.CO;2-W. Parámetro desconocido
|fechaaceso=ignorado (se sugiere|fechaacceso=) (ayuda); - ↑ P. Satyanarayana, P. Subrahmanyam, R. Kasai and O. Tanaka (1985). «An apiose-containing coumarin glycoside from gmelina arborea root». Phytochemistry 24 (8): 1862-1863. doi:10.1016/S0031-9422(00)82575-3.
Bibliografía
- Dean, F.M. (1963). Naturally Occurring Oxygen Ring Compounds. London: Butterworths. ISBN 978-0-408-26750-2.
- Joule, J.A.; Mills, K. (2000). Heterocyclic Chemistry (4th edición). Oxford: Blackwell Science. ISBN 978-0-632-05453-4.
- Comprehensive Natural Products Chemistry 2. Oxford: Elsevier. 1999. p. 677. ISBN 978-0-08-043154-3. Parámetro desconocido
|editor3-nombre=ignorado (se sugiere|nombre-editor3=) (ayuda); Parámetro desconocido|editor2-apellidos=ignorado (se sugiere|apellidos-editor2=) (ayuda); Parámetro desconocido|editor3-apellidos=ignorado (se sugiere|apellidos-editor3=) (ayuda); Parámetro desconocido|editor2-nombre=ignorado (se sugiere|nombre-editor2=) (ayuda); Parámetro desconocido|editor1-apellidos=ignorado (se sugiere|apellidos-editor1=) (ayuda); Parámetro desconocido|editor1-nombre=ignorado (se sugiere|nombre-editor1=) (ayuda)