Citoesqueleto

El citoesqueleto es un entramado tridimensional de proteínas que provee soporte interno en las células, organiza las estructuras internas e interviene en los fenómenos de transporte, tráfico y división celular. Consta de tres tipos de proteínas (microtúbulos, microfilamentos y filamentos intermedios).[1] En las células eucariotas, consta de filamentos de actina, filamentos intermedios, microtúbulos y septinas, mientras que en las procariotas está constituido principalmente por las proteínas estructurales FtsZ y MreB. El citoesqueleto es una estructura dinámica que mantiene la forma de la célula, facilita la movilidad celular (usando estructuras como los cilios y los flagelos), y desempeña un importante papel tanto en el tráfico intracelular (por ejemplo, los movimientos de vesículas y orgánulos) y en la división celular.
Tras el descubrimiento del citoesqueleto por el biólogo Keith Porter a principios de los años 80, el Dr. Donald Ingber consideró que, desde un punto de vista mecánico, la célula se comportaba de manera similar a estructuras arquitectónicas denominadas estructuras de tensegridad.[2]
La evolución del citoesqueleto ha sido un motivo de estudio actual, a partir de este enfoque se ha propuesto un modelo de evolución rápida conocido como el modelo de «complejidad temprana». Este modelo propone que a través de procesos de diversificación y especialización de moléculas ancestrales del citoesqueleto (proto-actina y proto-tubulina), se incrementó la complejidad del sistema en el último ancestro común de los eucariontes (LECA, por sus siglas en inglés last eucaryotic common ancestor). El incremento de complejidad en el LECA se produjo por un aumento en la cantidad de proteínas que conforman a cada uno de los filamentos, así como por la aparición de un gran número de proteínas motoras y accesorias.[3]
Mecanismos de movimiento celulares[editar]
Todas las células poseen movimientos celulares, como las corrientes citoplasmáticas, los movimientos de los organelos, los cromosomas y los cambios de morfología durante la división celular.[4]
Existen dos mecanismos de movimientos celulares: el montaje de proteínas contráctiles como la actina y la miosina, y las estructuras motoras permanentes formadas por la asociación de microtúbulos (cilios y flagelos). La actina participa en el mantenimiento de la organización citoplasmática, la movilidad celular y el movimiento interno de los contenidos celulares. En algunos casos, el movimiento es producido por la interacción entre actina y miosina, por ejemplo, los movimientos musculares de los vertebrados. Los cilios y flagelos son estructuras largas, delgadas y huecas que se extienden desde la superficie de las células eucariotas. Los cilios son cortos y aparecen en grandes cantidades, los flagelos son largos y escasos. Solo están ausentes en unos pocos grupos de eucariontes (algas rojas, hongos, plantas con flor y gusanos redondos).[4]
El citoesqueleto eucariota[editar]
Las células eucariotas tienen tres tipos de filamentos citoesqueléticos: microfilamentos, filamentos intermedios y microtúbulos. Las septinas se consideran el cuarto componente del citoesqueleto.[5]

Microfilamentos (actina y miosina)[editar]
Los microfilamentos tienen un diámetro de unos 3-7 nm (nanómetros) y se componen de dos cadenas de actina, que forman una hélice. Su mayor concentración se encuentra justo por debajo de la membrana plasmática, porque una de sus funciones es mantener la forma de la célula. Otras funciones son la formación de protuberancias citoplasmáticas como pseudópodos y microvilli, participar en las uniones intercelulares o de células con la matriz, la transducción de señales, la movilidad celular (en el caso de las células musculares, y junto con la miosina, permiten la contracción muscular) y en la citocinesis de células animales, la formación de un anillo contráctil que divide la célula en dos.
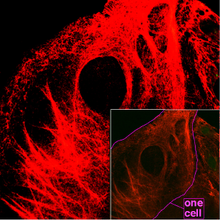
Filamentos intermedios[editar]
Son filamentos de proteína fibrosa de unos 12 nm de diámetro, que constituyen los componentes del citoesqueleto más estables (dando soporte a los orgánulos por sus fuertes enlaces) y más heterogéneos. Las proteínas que conforman estos filamentos, citoqueratina, vimentina, neurofilamentos, desmina y proteína fibrilar acídica de la glia, son dependientes del tejido en el que se hallen. Su función principal es la de organizar la estructura tridimensional interna de la célula (por ejemplo, forman parte de la envoltura nuclear y de los sarcómeros). También participan en algunas uniones intercelulares (desmosomas).

Microtúbulos[editar]
Los microtúbulos son estructuras tubulares de 25 nm de diámetro que se originan en los centros organizadores de microtúbulos y se extienden a lo largo del citoplasma. Se pueden polimerizar y despolimerizar según las necesidades de la célula. Se hallan en las células eucariotas y están formados por la polimerización de un dímero de dos proteínas globulares, tubulinas alfa y beta. Cada microtúbulo está compuesto de 13 protofilamentos formados por los dímeros de tubulina. Intervienen en diversos procesos celulares que involucran desplazamiento de vesículas de secreción, movimiento de orgánulos, transporte intracelular de sustancias, así como en la división celular (mitosis y meiosis), ya que forman el huso acromático. Además, constituyen la estructura interna de cilios y flagelos. Los microtúbulos son más flexibles pero más duros que la actina.
El citoesqueleto procariota[editar]

En el pasado se creía que el citoesqueleto era una característica única de las células eucarióticas, pero desde entonces se han encontrado homólogos bacterianos a las principales proteínas del citoesqueleto eucariota.[7] A pesar de que las relaciones evolutivas son tan distantes que no se pueden inferir analogías a partir de las secuencias de aminoácidos, la similitud de la estructura tridimensional, las funciones en el mantenimiento de la forma y en la polaridad de las células proporcionan pruebas sólidas de que los citoesqueletos eucariotas y procariotas son realmente homólogos.[8]
FtsZ[editar]
FtsZ, una proto-tubulina, fue la primera proteína del citoesqueleto procariota en ser identificada. Al igual que la tubulina, FtsZ forma filamentos en presencia de GTP, pero estos filamentos no se agrupan en microtúbulos. Durante la división celular, FtsZ es la primera proteína que se desplaza al lugar de la división y es esencial para organizar a las proteínas que sintetizan la nueva pared celular en las células que se dividen.
MreB y ParM[editar]
Las proteínas procariotas similares a la actina (también conocidas como proto-actinas), tales como MreB, están involucradas en el mantenimiento de la forma celular. Estas proteínas forman una red helicoidal debajo de la membrana celular que guía a las proteínas que participan en la biosíntesis de la pared celular. Todas las bacterias no esféricas tienen genes que codifican este tipo de proteínas.
Algunos plásmidos codifican un sistema de particionado que envuelve una proteína similar a la actina, denominada ParM. Los filamentos de ParM exhiben una inestabilidad dinámica y pueden particionar los plásmidos de ADN durante la división celular en un mecanismo análogo al utilizado por los microtúbulos durante mitosis de los eucariotas.
Crescentina[editar]
La bacteria Caulobacter crescentus contiene una tercera proteína, llamada crescentina, que está relacionada con los filamentos intermedios de las células eucarióticas. La crescentina también participa en el mantenimiento de la forma celular, pero el mecanismo actualmente es poco claro.[9]
Proteínas WACA[editar]
Las proteínas WACA pertenecen a la familia de ATPasas, presentan variación del motivo Walker A (KXXXXGKT), y están ampliamente distribuidas en los procariontes. En la mayoría de las bacterias los genes asociados codifican para uno o más miembros de estas proteínas y las cuales incluyen a las proteínas ParA, MinD, Soj, SopA, Parf, IncC y, probablemente, MipZ. MinD está involucrada en los procesos de división celular, su dinámica varía de acuerdo al organismo, por ejemplo en Escherichia coli se mueve de un extremo de la célula a otro, mientras que en Bacillus subtilis se mantiene en los polos de la célula.
ParA y Soj, participan en los procesos de segregación de cromosomas, transcripción y organización de plásmidos. En general el papel específico de esta familia de proteínas y su mecanismo molecular son poco entendidos.[10]
El citoesqueleto, la tensegridad y la mecanotransducción celular[editar]
El citoesqueleto es dinámico y no por ello pierde la capacidad del mantenimiento de la forma, la funcionalidad y la estructura de la red tridimensional que lo conforma. Uno de los sitios más recomendables de la WEB para observar mediante visualización científica lo que se ha generado al respecto, y para el cual se aplica el conocimiento generado al momento para el interior de una célula y su relación con la membrana plasmática. En este sitio, en The inner life of the cell, se puede observar lo que podría suceder al interior de unas células y la relación que con ello tiene el citoesqueleto, el cual está sujeta a propiedades biomecánicas relacionadas con tensión y compresión, las cuales son medibles y explicables mediante las leyes de la física relacionadas con la biomecánica. El balance entre estas propiedades le confieren a la célula una integridad tensional (conocida en el idioma inglés como “tensegrity”) y la cual se basa en lo visualizado en 1993 por el Dr. Donald Ingber,[11] científico que trasladó el concepto arquitectónico (en el cual se le conoce como tensegridad) al ámbito intracelular y que se mantiene vigente en nuestros días. En este sentido, una forma de ampliar visualmente la influencia de los fenómenos de tensión, longitud, rigidez, compresión producidas por las proteínas del citoesqueleto actina y tubulina, así como de la matriz extracelular y las integrinas, es lo presentado en la página WEB del Children's Hospital Boston denominado Tensegrity in a Cell;[12] sitio en el cual las animaciones producidas de manera interactiva por la influencia de las fuerzas indicadas generan cambios en las células y los cuales pueden ser comparados con imágenes obtenidas mediante el microscopio de fluorescencia.
La estructuración y la dinámica del citoesqueleto dependen de la forma en que la célula se relaciona con la matriz extracelular y tal relación es lo que determina la biomecánica de las células. Un ejemplo de ello podría ser la dinámica con la que las células ciliadas se presentan ante su entorno como lo propuesto para las células flama de los protonefridios del céstodo Taenia solium.[13] Recientemente, Hersen y Ladoux[14] han hecho referencia a que la mecanobiología es un campo emergente que investiga como las células vivas sienten y responden a las fuerzas mecánicas de su entorno. Su comentario hace referencia a que las células están continuamente percatándose de las fuerzas que se suceden a su alrededor aun cuando se encuentran en migración. Tales fuerzas inducen que las células no solo sufran deformaciones sino que también inducen a que se presenten fenómenos como señalización por adhesión y reorganización del citoesqueleto. Estos fenómenos, en referencia a la estrategia experimental que publicaron Delanoë-Ayari y colaboradores,[15] indican que una célula tiene la capacidad de sentir tanto las fuerzas horizontales como las verticales que se presentan durante su desplazamiento y que muestran la importancia que juega la interacción tridimensional entre las células y la matriz extracelular. Las características mecánicas de la matriz extracelular (rigidez y deformabilidad) son factores importantes que influyen en la conducta y la dinámica de las células[16] tales como la diferenciación, la proliferación, la supervivencia, la polaridad y la migración.[17] La mecanotransducción, que se ha establecido como la transformación de fuerzas físicas en señales químicas, es capaz de generar una morfogénesis de un epitelio y ello se puede dar por la generación de modificaciones postransduccionales como la fosforilación de filamentos intermedios como lo demostrado recientemente con el estudio del nematodo Caenorhabditis elegans.[18] Esto resulta un aspecto interesante de la dinámica de la reestructuración del citoesqueleto, ya que se ha encontrado que con los estudios que se efectuaron se muestran que los filamentos intermedios también se mueven y no solo son de soporte y estructura celular. Esto abre un universo importante de como en un ambiente tisular las células contráctiles pueden ejercer influencia en las células de epitelio para que se diferencien y con ello, se favorezcan aspectos de regeneración tisular o diseminación de procesos cancerosos.
La tensión con que se presenta el citoesqueleto de una célula, en un momento dado, está influenciado por la dinámica celular y la forma de su núcleo. Cualquier aspecto que induzca cambios en las fuerzas intracelulares que ejercen los componentes del citoesqueleto, derivados de su interacción con el medio extracelular, induce a que también se den cambios en la forma de los núcleos celulares.[19] La constitución del núcleo celular, relacionada con su viscoelasticidad, puede tener un papel determinante en las interacciones biomecánicas que se dan entre el núcleo, el citoesqueleto y la matriz extracelular. Además, sus propiedades viscoelásticas podrían tener importantes implicaciones en el estudio de la transducción de señales mecánicas. Se sabe que el núcleo tiene comportamiento como un sólido viscoelástico y por ello presenta propiedades distintas a las del citoplasma. Por consiguiente, es de esperarse que cualquier deformación que sufra, así como las propiedades mecánicas que presenta núcleo podrían estar influenciadas por el estado de tensión-compresión al que esté sometida una célula.[20] Los núcleos celulares también tienen una dinámica propia debida a su composición; cuando una célula va de un lado a otro o bien, pasa a través de un diámetro menor al suyo, la deformación del núcleo también se presenta acorde al que presenta la célula completa. El tamaño y la forma de los núcleos celulares es variable y depende del tipo celular. Su dinámica está asociada a la del citoesqueleto y por consiguiente, la composición del nucleoesqueleto está intrínsecamente conectado al citoesqueleto. De hecho se ha indicado que la plasticidad del núcleo celular en las células cancerosas es una determinante para que éstas se diseminen.[21]
Mecanotransducción es un término que implica que las fuerzas mecánicas aplicadas a las células se transforman en sucesos bioquímicos relevantes y que debido a ellos, se generan diferentes procesos asociados al desarrollo, la fisiología y la patología.[22] Según los autores de la revisión citada, la mecanotransducción celular es un campo de estudio de rápido avance en la investigación científica actual. La relación que el citoesqueleto guarda con la mecanotransducción es estrecha: las células son materiales deformables que basan su forma y tamaño en el citoesqueleto y por consiguiente, cualquier fuerza que las afecte genera cambios que se traducen en distintas actividades celulares. Según lo que se ha establecido, son las propiedades de viscoelasticidad del citoesqueleto lo que define sus propiedades mecánicas y que gracias a ellas tenga la plasticidad requerida. Sin embargo, esto es un tema aún controversial. La demostración de como se presenta la mecanotransducción es un reto tecnológico muy interesante ya que son varias las formas con que este fenómeno puede ser evaluado a nivel de las células y van desde la compresión de membranas, el corte por estrés, el uso de pinzas ópticas, la aplicación de fuerzas magnéticas,[23] el uso del microscopio de fuerza atómica y la aspiración con micropipetas entre otras[24]
Papel de la mecanotransducción en la invasión por patógenos[editar]
Según Hoffman et al[22] el prendido y apagado de la mecanotransducción (del inglés switch-like model) está integrado por tres fenómenos: la mecanosensación, la mecanotransmisión y la mecanorespuesta. Cuando las células responden a estímulos mecánicos tanto externos como internos, un conjunto molecular denominado mecanosensor sufre cambios conformacionales que le permite a las células el detectar tales estímulos. Luego estos estímulos son transmitidos al interior celular a través de los largos filamentos del citoesqueleto y esto se refiere al fenómeno de mecanotransmisión. Las señales generadas por estos estímulos se transducen en la activación de señales intracelulares en las que participan segundos mensajeros, con lo que finalmente se genera una mecanorespuesta celular. Hay que considerar que estos fenómenos se presentan de forma secuencial en un intervalo de tiempo del orden de cientos de milisegundos y que pueden ser acelerados o retrasados por cambios en la intensidad y la frecuencia de las fuerzas, así como de las condiciones del microambiente que los originaron. Un ejemplo de la importancia de la mecanotransducción en la invasión por patógenos es la propuesta para hongos como Candida albicans y Magnaporthe grisea hecha por Kumamoto en 2008.[25] Un trabajo muy interesante en el que se induce una fuerza magnética a trofozoítos de la ameba Entamoeba histolytica, los cuales previamente se activaron por la fagocitosis de perlitas magnéticas recubiertas con proteínas humanas séricas, muestra que la mecanotransducción generada induce a que la célula modifique su migración hacia un solo sitio y que la mecanosensación se da por activación de la cinasa de fosfatidilinositol y la reestructuración de la actina.[26] Según estos autores, la mecanotransducción inducida en estos patógenos, que orienta la dirección de migración de ellos, podría estar relacionado con cambios en su virulencia, lo cual podría ser determinante en la invasión de los tejidos humanos infectados. La mecanotransducción también podría ser relevante para el comportamiento de los patógenos durante su interacción con las células de sus hospederos; recientemente, mediante la evaluación de la adhesión de protozoarios de Gardia lamblia a vidrio por marcaje fluorescente in vivo del disco suctor y de los flagelos ventrales, se encontró que la fuerza con la que el disco suctor de estos parásitos se adhiere a su sustrato es tan fuerte, lo cual podría ser suficiente para evitar que el parásito se despegue. Esta estructura celular de G. lamblia tiene un diseño tal como una copa de succión que genera un vacío gracias al cual se adhiere firmemente al tejido intestinal. Esto si se tradujese a lo que el parásito hace con el epitelio intestinal, podría dar una explicación de porque aun cuando el intestino entre en peristalsis, este tipo de protozoarios permanezcan adheridos.[27]
El citoesqueleto durante la migración celular[editar]
La migración celular es un término usado para referirse a fenómenos que implican el desplazamiento de las células, lo cual puede ocurrir en diferentes sustratos; por ejemplo, el suelo en el caso de amibas como Naegleria fowleri,[28] bajo condiciones in vitro o bajo condiciones in vivo (dentro de los organismos). La migración es una respuesta a diferentes estímulos como la necesidad de alimentarse de las células, cambios morfológicos (embriogénesis, organogénesis y regeneración de heridas) o, bien, ante la presencia de factores solubles que estimulan y señalizan a otros eventos tales como la inflamación.[29]
Según el contexto en el que las células migran y el tipo de célula involucrada, existen diferentes formas de migración. Una de las más conocidas, dependiente de quimioatrayentes, es llamada quimiotaxis. A diferencia de la quimiotaxis, la quimioquinesis genera un desplazamiento azaroso. La migración celular en respuesta a un ligando que se encuentra unido o inmóvil a una matriz se denomina haptotaxis. Si la migración depende del sustrato (en el que es importante la topografía de la superficie, su naturaleza química, su rugosidad, etc.) se presenta una adhesión y se activan diversos mecanismos de interacciones moleculares (integrinas, cinasa de adhesión focal) y se genera una reorganización del citoesqueleto y ello ha generado un fenómeno denominado durotaxis. La durotaxis es la tendencia de las células para avanzar hacia sustratos más rígidos (por ejemplo metales como cobre), pero no ha sido completamente descrita. Se sabe que, en caso de células mesenquimales humanas, participan integrinas, cinasa de adhesión focal (FAK) y miosinas no musculares tipo II. Es interesante que durante el fenómeno en que se presenta la durotaxis, hay un cambio de señales mecánicas a bioquímicas (mecanotransducción), por lo cual se les debe tomar en cuenta cuando se intente el reproducir in vitro un fenómeno biológico o bien, cuando se busque efectuar una terapia celular.[30]
La dinámica del citoesqueleto es crucial para que las células vayan de un lugar a otro como se ilustra con la serie de imágenes y videos obtenidos experimentalmente bajo la excelente composición interactiva concebida por el Dr. Vic Small y que se ha denominado como un viaje visual de la motilidad celular.[31] En este sitio uno puede percatarse de lo interesante que resultan tanto la forma como el tamaño que adoptan las células en un momento determinado durante su migración y que aun así de haber desplegado tal dinámica y reorganización, las células no pierden la capacidad de regresar a su estado original cuando éstas se encuentran en reposo. Aun así, el citoesqueleto en la célula en reposo es dinámico, no se detiene porque son perennes las funciones básicas de tráfico y movimiento intracelulares. Como ya había sido descrito anteriormente, al hacer referencia a la vida interior de las células[32] y lo que de manera animada se presenta en el sitio; una célula se desplaza de un lugar a otro, interacciona con otras células y durante estos fenómenos puede cambiar radicalmente su forma y tamaño pero no deja de tener una dinámica intracelular que le ofrece el citoesqueleto. Un excelente ejemplo de la migración celular inducida por sustancias que atraen células y que provienen de otras dañadas, con fines de reparación de estas últimas, es la migración de neutrófilos luego de su adhesión desde los sinusoides hepáticos hacia los focos de hepatocitos dañados durante el fenómeno de inflamación estéril[33] y del cual se puede observar un interesante video en la sección VideoLab de la revista Science. En el video, los neutrófilos teñidos con fluorescencia en color verde, sufren modificaciones en su forma y tamaño durante su migración hacia el foco de hepatocitos dañados (teñidos fluorescentemente en color rojo) a los cuales intentan restaurar. Previo a su migración, los neutrófilos se encuentran adheridos a las paredes de los sinusoides hepáticos (teñidos fluorescentemente en color azul) y cambian su forma y tamaño al dirigirse hacia el foco mencionado.
Con la tecnología microscópica actual es posible observar y videofilmar la manera en que el citoesqueleto se reestructura durante la migración celular. Los recursos tecnológicos son diversos, y ellos permiten la visualización desde el nivel micrométrico hasta el nanométrico.[31] Las necesidades de conocer que eventos se suceden en el interior de una célula durante su migración es una preocupación que, por su estudio, se espera que puedan ser mejorados otros aspectos de la biología celular pocos conocidos. Un ejemplo de ello es la suma de esfuerzos de investigadores que estudian la migración celular.[34] Debido a los estudios que se han realizado en células que migran, se ha demostrado que ellas se desplazan mediante la continua interacción con la matriz extracelular que les rodea mediante la interacción continua con focos de adhesión o puntos focales. La forma en que las células interaccionan con dicha matriz, depende de la composición y forma de la misma, por consiguiente las células adoptan la forma del medio en el que se encuentran desplazando, como se demostró mediante videomicroscopía y el uso de marcadores fluorescentes (Doyle et al, 2009).[35] El material suplementario asociado al trabajo de estos autores, es una muestra fantástica de como las células adquieren tal migración e incluso se puede observar al mismo tiempo (ver video 4 en relación con la migración de queratinocitos) como realizan sus movimientos intracelulares.[36] El citoesqueleto pertenece a las células vegetales y animales.
La migración in vivo de células dendríticas puede ser visualizada por medio de marcadores como 19F/1H usando imagen por resonancia magnética nuclear en 3D en ratones. La técnica puede ser vista con más detalle en la página web de la revista JoVE (por sus siglas en inglés The Journal of Visualized Experiments); la cual da paso a paso la técnica y detalles de ella.[37]
Referencias[editar]
- ↑ Fried (1990). «4». Biología. p. 42. Consultado el 2 de marzo de 2020.
- ↑ Ingber, Donald E. (2003-4). «Tensegrity I. Cell structure and hierarchical systems biology». Journal of Cell Science 116 (7). ISSN 0021-9533. doi:10.1242/jcs.00359. Consultado el 30 de noviembre de 2022.
- ↑ Wickstead B, Gull K. The evolution of the cytoskeleton. J Cell Biol. 2011 Aug 22;194(4):513-25. doi: 10.1083/jcb.201102065.
- ↑ a b Adriana Schnek, Alicia Massarini. Curtis. Biología. Medica Panamencana. ISBN 978-9500603348.
- ↑ Mostowy S, Cossart P. Septins: the fourth component of the cytoskeleton. Nat Rev Mol Cell Biol. 2012 Feb 8;13(3):183-94. doi: 10.1038/nrm3284. Review.
- ↑ Gitai, Z. (2005). «The New Bacterial Cell Biology: Moving Parts and Subcellular Architecture». Cell 120 (5): 577-86. doi:10.1016/j.cell.2005.02.026.
- ↑ Shih YL, Rothfield L (2006). «The bacterial cytoskeleton». Microbiol. Mol. Biol. Rev. 70 (3): 729-54. PMC 1594594. PMID 16959967. doi:10.1128/MMBR.00017-06.
- ↑ Michie KA, Löwe J (2006). «Dynamic filaments of the bacterial cytoskeleton». Annu. Rev. Biochem. 75: 467-92. PMID 16756499. doi:10.1146/annurev.biochem.75.103004.142452. Archivado desde el original el 11 de septiembre de 2008. Consultado el 28 de junio de 2008.
- ↑ Charbon, G., Cabeen, M.T. y Jacobs-Wagner, C. (2009). «Bacterial intermediate filaments: in vivo assembly, organization, and dynamics of crescentin». Genes & development (Cold Spring Harbor Lab) 23 (9): 1131.
- ↑ Michie KA, Löwe J. Dynamic filaments of the bacterial cytoskeleton. Annu Rev Biochem. 2006;75:467-92.
- ↑ https://web.archive.org/web/20110520183302/http://www.childrenshospital.org/cfapps/research/data_admin/Site97/mainpageS97P0.html
- ↑ «Tensegrity in a Cell.». Archivado desde el original el 6 de octubre de 2008. Consultado el 17 de febrero de 2011.
- ↑ Valverde-Islas L, Arrangoiz E, Vega E, Robert L, Villanueva R, Reynoso-Ducoing O, Willms K, Zepeda-Rodriguez A, Fortoul T, Ambrosio J (2011). «Visualization and 3D Reconstruction of Flame Cells of Taenia solium (Cestoda)». PLOS ONE 6 (3): e14754. PMC 3055865. PMID 21412407. doi:10.1371/journal.pone.0014754.
- ↑ Pascal Hersen; Benoit Ladoux (2011). «Push it, pull it». Nature 470: 340-1. doi:10.1038/470340a.
- ↑ Delanoë-Ayari H, Rieu JP and Sano M. (2010). «4D Traction Force Microscopy Reveals Asymmetric Cortical Forces in Migrating Dictyostelium Cells». Phys. Rev. Lett. 105 (24): 248103. doi:10.1103/PhysRevLett.105.248103.
- ↑ «Copia archivada». Archivado desde el original el 20 de diciembre de 2011. Consultado el 24 de febrero de 2011.
- ↑ Hynes RO. The extracellular matrix not just pretty fibrils. Science. 27 (236): 1216-1219. 2009.
- ↑ Zhang H, Landmann F, Zahreddine H, Rodriguez D, Koch M and Labouesse M. A tension-induced mechanotransduction pathway promotes epithelial morphogenesis. Nature 471; 99-103. 2011.
- ↑ Sims JR, Karp S and Ingber DE. J. Cell Sci. 103; 1215-1222. 1992.
- ↑ Guilak F, Tedrow JR, Burgkart R. Biochem. Biophys. Res. Commun. 269; 781-786. 2000.
- ↑ Friedl P, Wolf K, Lammerding J. Nuclear mechanics during cell migration. Curr. Op. Cell Biol. 23: 55-64. 2011.
- ↑ a b Hoffman BD, Grashoff C, Schwartz MA. Dynamic molecular processes mediate cellular mechanotransduction. Nature 475 (21) 316. 2011.
- ↑ aplicación de fuerzas magnéticas
- ↑ Huang H, Kamm RD, Lee RT. Cell mechanics and mechanotransduction: pathways, probes, and physiology. Am J Physiol Cell Physiol 287: C1-C11. 2004.
- ↑ Kumamoto CA. Molecular mechanisms of mechanosensing and their roles in fungal contact sensing. Nat Rev Microbiol. 2008 Sep;6(9):667-73.
- ↑ Rivierea C, Marion S, Guillen N, Bacria JC, Gazeaua F, Wilhelm C. Signaling through the phosphatidylinositol 3-kinase regulates mechanotaxis induced by local low magnetic forces in Entamoeba histolytica. Journal of Biomechanics 40: 64–77. 2007.
- ↑ House SA, Richter DJ, Pham JK, Dawson SC, 2011 Giardia Flagellar Motility Is Not Directly Required to Maintain Attachment to Surfaces. PLoS Pathog 7(8): e1002167. doi:10.1371/journal.ppat.1002167.
- ↑ «Copia archivada». Archivado desde el original el 21 de abril de 2013. Consultado el 18 de abril de 2013.
- ↑ «Copia archivada». Archivado desde el original el 23 de abril de 2011. Consultado el 5 de abril de 2011.
- ↑ Vicente-Manzaneres, M. Cell Migration: Cooperation between Myosin II Isoforms in Durotaxis. Current biology 23 (1): pp R28-R29, 2013.
- ↑ a b [1]
- ↑ «Copia archivada». Archivado desde el original el 10 de febrero de 2011. Consultado el 17 de febrero de 2011.
- ↑ McDonald B, Pittman K, Menezes GB, Hirota SA, Slaba I, Waterhouse CCM, Beck PL, Muruve DA and Kubes P. Intravascular danger signals guide neutrophiles to sites of sterile inflammation. Science 3330(6002): 362-366. 2010.
- ↑ «Copia archivada». Archivado desde el original el 11 de diciembre de 2014. Consultado el 5 de abril de 2011.
- ↑ Doyle AD, Wang FW, Matsumoto K and Yamada KM. One-dimensional topography underlies three-dimensional fibrillar cell migration. JCB. 184(4): 481-490. 2009.
- ↑ http://jcb.rupress.org/content/suppl/2009/02/20/jcb.200810041.DC1
- ↑ http://www.jove.com/
Enlaces externos[editar]
 Wikimedia Commons alberga una categoría multimedia sobre Citoesqueleto.
Wikimedia Commons alberga una categoría multimedia sobre Citoesqueleto.- http://www.cellmigration.org/resource/imaging/#tech Archivado el 13 de mayo de 2011 en Wayback Machine.
