Anticuerpos anticitoplasma de neutrófilos

Los anticuerpos anticitoplasma de neutrófilos (ANCAs) son un grupo de autoanticuerpos, principalmente de tipo IgG, dirigidos contra antígenos que se encuentran presentes en el citoplasma de los granulocitos neutrófilos (el tipo más común de leucocito) y contra el citoplasma de monocitos. Se pueden detectar por medio de un análisis sanguíneo en un gran número de enfermedades autoinmunes, pero se encuentran particularmente asociados a la vasculitis sistémica, también llamada vasculitis asociada a ANCA.
Tipos[editar]
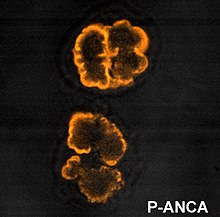
Los ANCA fueron originalmente divididos en dos grandes clases, los c-ANCA y los p-ANCA, basados en los patrones de tinción inmunofluorescente que se observaba en neutrófilos fijados en etanol al ser enfrentados a los anticuerpos del paciente. Los títulos de ANCAs generalmente se miden por medio de ELISA y por inmunofluorescencia indirecta (IFI).[1]
- p-ANCA, o patrón de fluorescencia perinuclear (tinción protoplasmática) los anticuerpos anticitoplasma de neutrófilos muestran un patrón de fluorescencia en forma de anillo, rodeando al núcleo. El antígeno diana es generalmente la mieloperoxidasa (MPO).
- c-ANCA, o patrón de fluorescencia citoplasmático (clásico). En este caso los anticuerpos anticitoplasma de neutrófilos muestran un patrón de tinción citoplasmático difuso y granular. El antígeno diana es más frecuentemente la proteinasa 3 (PR3).
- Algunos ANCA atípicos, dirigidos contra antígenos diferentes de la MPO o de la PR3, pueden ocasionalmente producir un patrón de fluorescencia en parches al ser visualizados por inmunofluorescencia, y se da más frecuentemente en pacientes con enfermedades asociadas a la formación de ANCA pero diferentes de la vasculitis. Este patrón de fluorescencia es comúnmente llamado 'patrón nevado'.
- En algunos procesos patológicos, es posible observar un tercer tipo distintivo de ANCA, los x-ANCA. Estos son un hallazgo frecuente en las enfermedades inflamatorias crónicas de intestino.[2]
Desarrollo[editar]
Todavía se entiende muy póbremente cómo es que los ANCA se desarrollan, aunque se han sugerido varias hipótesis. Es posible que haya una contribución genética, sobre todo de parte de los genes que controlan el nivel de la respuesta inmune, aunque muy probablemente esta susceptibilidad genética se encuentra relacionada con factores ambientales. Entre algunos de estos posibles factores se postula a la vacunación o la exposición a silicatos. Se han postulado dos posibles mecanismos de desarrollo de ANCAs, aunque ninguna de estas teorías responde a la pregunta de cómo es que se desarrollan las diferentes especificidades de estos anticuerpos, y todavía queda mucho trabajo de investigación por hacer en este campo.[3]
Teoría del mimetismo molecular[editar]
Los superantígenos microbianos son moléculas expresadas por las bacterias y otros microorganismos que poseen la capacidad de desatar una potente respuesta inmune por medio de la activación de linfocitos T. Estas moléculas generalmente poseen regiones que semejan a antígenos del organismo hospedador, esto promueve una respuesta autoinmune residual. Se han caracterizado superantígenos estafilocóccicos y estreptocóccicos en relación con enfermedades autoinmunes, el ejemplo clásico es el dado por los estreptococos del grupo A que causan enfermedad reumática del corazón. En este caso existe una similitud entre la proteína M del Streptococcus pyogenes y la miosina y laminina cardíacas. También se ha demostrado que más del 70% de los pacientes con granulomatosis de Wegener son portadores nasales de Staphylococcus aureus siendo que los portadores poseen un riesgo ocho veces mayor de desarrollar la enfermedad.[3] Esta podría por lo tanto ser considerada una reacción de hipersensibilidad de tipo II.
Teoría de la apoptosis deficiente[editar]
La apoptosis, o muerte celular programada, de los neutrófilos es de vital importancia para el control de la duración de la respuesta inflamatoria temprana, restringiendo de esta manera el daño provocado a los tejidos por los propios neutrófilos. Los ANCA podrían aparecer ya sea por una apoptosis ineficiente, o por un mecanismo de remoción de fragmentos celulares apoptóticos deficiente, conduciendo a que queden expuestas al sistema inmune moléculas que normalmente estarían ocultas, secuestradas dentro de las células. Esta teoría resuelve la paradoja de como puede ser posible que se desarrollen anticuerpos contra los antígenos intracelulares hacia los cuales están dirigidos los ANCA.[3]
Rol en la enfermedad[editar]
Hay tres enfermedades primarias que se encuentran consistentemente asociadas con ANCAs: granulomatosis de Wegener, poliangitis microscópica y glomerulonefritis. Se asume que estos anticuerpos están involucrados en la generación y/o progresión de las lesiones y signos clínicos.
Clásicamente los c-ANCA se han encontrado asociados a granulomatosis de Wegener, los p-ANCA asociados a poliangitis microscópica y glomerulonefritis necrosante focal y semilunar. Sin embargo, en años recientes se han identificado ANCAs dirigidos contra otros autoantígenos.[4]
Pacientes que padecen muchas otras enfermedades tales como la colitis ulcerativa y la espondilitis anquilosante, comúnmente presentan ANCAs también. Sin embargo en estos casos no hay vasculitis asociada, y se cree que los ANCAs son un epifenómeno incidental antes que una parte en si de la enfermedad. El síndrome de Churg-Strauss se encuentra asociado a p-ANCAs dirigidos contra la MPO.[5]
Todavía resulta poco claro cuál es el rol de los ANCAs en estas enfermedades, bien podrían ser marcadores de la enfermedad o formar parte en el proceso patogénico. Se ha demostrado que en la granulomatosis de Wegener hay una correlación positiva entre el título de ANCA y la actividad de la enfermedad; y en estudios in vitro se ha demostrado que los ANCA causan la activación de los neutrófilos imprimados y reaccionan con las células epiteliales que expresan PR3.[3] los ANCA podrían actuar causando la liberación de enzimas líticas de parte de los granulocitos y otros glóbulos blancos,[6] causando la inflamación de las paredes de los vasos sanguíneos (esto es vasculitis). Los ANCA asociados a vasculitis, usualmente se presentan con la característica de que causan vasculitis de vasos pequeños.
Historia[editar]
Los ANCAs fueron descritos por primera vez por Davies y colaboradores asociados a glomerulonefritis segmentaria necrosante,[7] y por van der Woude et al. en 1985 en la enfermedad de Wegener.[8] Los Segundos Talleres Internacionales sobre ANCA, llevados a cabo en mayo de 1989 en los Países Bajos, sentaron las bases de la nomenclatura de los patrones perinuclear y citoplasmático, mientras que los antígenos MPO y PR3 eran descubiertos en 1988 y 1989 respectivamente.[9] Desde entonces el International ANCA Workshops se ha llevado a cabo cada dos años.
Véase también[editar]
Enlaces externos[editar]
- imágenes de pANCA y cANCA Archivado el 27 de septiembre de 2012 en Wayback Machine.
- imágenes fluorescentes de ANCA Archivado el 26 de marzo de 2007 en Wayback Machine.
- MeSH: Anti-Neutrophil+Cytoplasmic+Antibody (en inglés)
Referencias[editar]
- ↑ Radice A & Sinico RA. Antineutrophil cytoplasmic antibodies (ANCA). Autoimmunity 2005;38(1):93-103. PMID 15804710
- ↑ «Copia archivada». Archivado desde el original el 17 de noviembre de 2006. Consultado el 21 de marzo de 2012.
- ↑ a b c d Reumaux D, Duthilleul P, Roos D. Pathogenesis of diseases associated with antineutrophil cytoplasm autoantibodies. Hum Immunol 2004;65(1):1-12. PMID 14700590.
- ↑ Kain R, Matsui K, Exner M et al. A novel class of autoantigens of anti-neutrophil cytoplasmic antibodies in necrotizing and crescentic glomerulonephritis: the lysosomal membrane glycoprotein h-lamp-2 in neutrophil granulocytes and a related membrane protein in glomerular endothelial cells. J Exp Med 1995;181(2):585-597. PMID 7836914
- ↑ Seo P & Stone J. The Antineutrophil Cytoplasmic Antibody-Associated Vasculitides. Am J Med 2004;117:39-50. PMID 15210387
- ↑ Falk RJ, Terrell RS, Charles LA, Jennette JC. Anti-neutrophil cytoplasmic autoantibodies induce neutrophils to degranulate and produce oxygen radicals in vitro. Proc Natl Acad Sci U S A 1990;87:4115-4119. PMID 2161532.
- ↑ Davies DJ, Moran JE, Niall JF, Ryan GB. Segmental necrotising glomerulonephritis with antineutrophil antibody: possible arbovirus aetiology. Brit Med J 1982;285:606. PMID 6297657.
- ↑ van der Woude FJ, Rasmussen N, Lobatto S et al. Autoantibodies against neutrophils and monocytes: tool for diagnosis and marker of disease activity in Wegener's granulomatosis. Lancet 1985;1(8426):425-9. PMID 2857806.
- ↑ Jennette JC, Hoidal JR, Falk RJ. Specificity of anti-neutrophil cytoplasmic autoantibodies for proteinase 3. Blood 1990;75:2263-4. PDF (2 MB). PMID 2189509.
