Acetoacetato de etilo
| Acetoacetato de etilo | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| 3-Oxobutanoato de etilo | ||
| General | ||
| Otros nombres | Acetilacetato de etilo | |
| Fórmula molecular | C6H10O3 | |
| Identificadores | ||
| Número CAS | 141-97-9[1] | |
| ChEMBL | CHEMBL169176 | |
| ChemSpider | 13865426 | |
| KEGG | C03500 | |
| Propiedades físicas | ||
| Apariencia | incoloro | |
| Densidad | 1021 kg/m³; 1,021 g/cm³ | |
| Masa molar | 13 014 g/mol | |
| Punto de fusión | −45 °C (228 K) | |
| Punto de ebullición | 180,8 °C (454 K) | |
| Propiedades químicas | ||
| Acidez | 10,68 pKa | |
| Solubilidad en agua | 2.86 | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El compuesto orgánico acetoacetato de etilo es el éster etílico del ácido acetoacético. Se utiliza principalmente como un producto químico intermedio en la producción de una amplia variedad de compuestos, tales como aminoácidos, analgésicos, antibióticos, agentes antimaláricos, fenazona y aminofenazona, y vitamina B1; así como la fabricación de colorantes, tintes, tintas, lacas, perfumes, plásticos, y pigmentos. Solo, sin ser usado como intermedio, se utiliza como saborizante para alimentos.
Síntesis
El acetoacetato de etilo se produce industrialmente por tratamiento de dicetena con etanol.[2]
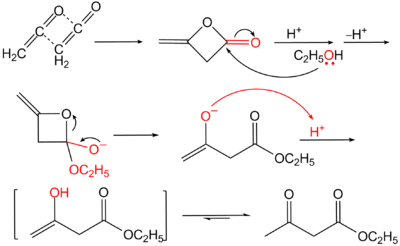
La preparación de acetoacetato de etilo es un procedimiento clásico de laboratorio.[3] Se prepara por medio de la condensación de Claisen del acetato de etilo. Dos moles de acetato de etilo se condensan para formar un mol de acetoacetato de etilo y otro de etanol.
Reactividad
Se utiliza a menudo en la síntesis del éster acetoacético, reacción similar a la del malonato de dietilo en la síntesis malónica o la condensación de Knoevenagel. Los protones alfa a los grupos carbonilo son ácidos, y el carbanión resultante puede someterse a una sustitución nucleófila. Una descarboxilación térmica posterior también es posible.[4]
El acetoacetato de etilo está sujeto a la tautomería ceto-enólica:

Similar al comportamiento de la acetilacetona, el enolato del acetoacetato de etilo también puede servir como un ligando bidentado. Por ejemplo, forma complejos de coordinación púrpuras con sales de hierro (III):
El acetoacetato de etilo también se puede reducir a acetato de 3-hidroxibutirato.
Referencias
- ↑ Número CAS
- ↑ Wilhelm Riemenschneider and Hermann M. Bolt “Esters, Organic” Ullmann's Encyclopedia of Industrial Chemistry 2005, Wiley-VCH, Weinheim. doi 10.1002/14356007.a09_565.pub2
- ↑ J. K. H. Inglis and K. C. Roberts (1926). "Ethyl Acetoacetate". Org. Synth.; Coll. Vol. 1: 235.
- ↑ Carey, Francis A. (2006). Organic Chemistry (Sixth Edition edición). New York, NY: McGraw-Hill. ISBN 0-07-111562-5.



