Ácido conjugado
| Ácidos y Bases | |
|---|---|

| |
| Ácidos y Bases | |
| |
| Tipos de ácidos | |
| Tipos de bases | |
Un ácido conjugado, dentro de la teoría del ácido-base de Brønsted-Lowry, es un compuesto químico formado por la recepción de un protón (H+) por una base; en otras palabras, es una base con un ion de hidrógeno agregado. Por otro lado, una base conjugada es lo que queda después de que un ácido ha donado un protón durante una reacción química. Por lo tanto, una base conjugada es una especie formada por la eliminación de un protón de un ácido.[1] Debido a que algunos ácidos son capaces de liberar múltiples protones, la base conjugada de un ácido puede ser ácida.
En resumen, esto se puede representar como la siguiente reacción química:
- Ácido + Base
 Conjugado Base + Ácido conjugado
Conjugado Base + Ácido conjugado
Johannes Nicolaus Brønsted y Martin Lowry introdujeron la teoría de Brønsted-Lowry, que proponía que cualquier compuesto que pueda transferir un protón a cualquier otro compuesto es un ácido, y el compuesto que acepta el protón es una base. Un protón es una partícula nuclear con una unidad de carga eléctrica positiva; está representado por el símbolo H+ porque constituye el núcleo de un átomo de hidrógeno,[2] es decir, un catión de hidrógeno.
Un catión puede ser un ácido conjugado, y un anión puede ser una base conjugada, dependiendo de qué sustancia está involucrada y de qué teoría ácido-base es el punto de vista. El anión más simple que puede ser una base conjugada es el electrón solvatado cuyo ácido conjugado es el hidrógeno atómico.
Reacciones ácido-base
[editar]En una reacción ácido-base, un ácido más una base reacciona para formar una base conjugada más un ácido conjugado:
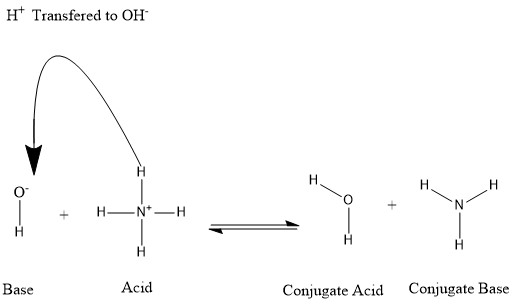
Los conjugados se forman cuando un ácido pierde un protón de hidrógeno o una base gana un protón de hidrógeno. Consulte la siguiente figura:
Decimos que la molécula de agua es el ácido conjugado del ion hidróxido después de que este último recibió el protón de hidrógeno donado por amonio. Por otro lado, el amoníaco es la base conjugada para el ácido amonio después de que el amonio ha donado un ion hidrógeno a la producción de la molécula de agua. También podemos referirnos a OH- como una base conjugada de H
2O, ya que la molécula de agua dona un protón hacia la producción de NH+
4 en la reacción inversa, que es el proceso predominante en la naturaleza debido a la fuerza de la base NH
3 sobre el ion hidróxido. Sobre la base de esta información, está claro que los términos "Ácido", "Base", "ácido conjugado" y "base conjugada" no están fijados para una determinada especie química; pero son intercambiables según la reacción que tenga lugar.
Fuerza de los conjugados
[editar]La fuerza de un ácido conjugado es directamente proporcional a su constante de disociación. Si un ácido conjugado es fuerte, su disociación tendrá una mayor constante de equilibrio y se favorecerán los productos de la reacción. La fuerza de una base conjugada puede verse como la tendencia de la especie a "tirar" de los protones de hidrógeno hacia sí misma. Si una base conjugada se clasifica como fuerte, "se aferrará" al protón de hidrógeno cuando esté en solución y su ácido no se disocie.
Por otro lado, si una especie se clasifica como un ácido fuerte, su base conjugada será de naturaleza débil. Un ejemplo de este caso sería la disociación del ácido clorhídrico HCl en agua. Dado que el HCl es un ácido fuerte (se disocia en gran medida), su base conjugada ( Cl−
) será una base conjugada débil. Por lo tanto, en este sistema, la mayoría de H+
tendrá la forma de un ion hidronio H
3O+
en lugar de unirse a un anión Cl y la base conjugada será más débil que una molécula de agua.
De manera similar, si un ácido es débil, su base conjugada será fuerte. Al considerar el hecho de que Kw es igual al producto de las concentraciones de H+ y OH. Un ácido débil tendrá una baja concentración de H+. El Kw (1.0 x 10 -14) dividido por una concentración baja de H+ también dará como resultado una concentración baja de OH-. Por lo tanto, los ácidos débiles tendrán bases conjugadas débiles, a diferencia de la idea errónea de que tienen bases conjugadas fuertes.
Identificación de pares conjugados ácido-base
[editar]El ácido y la base conjugada, así como la base y el ácido conjugado, se conocen como pares conjugados. Cuando se encuentra un ácido o base conjugada, es importante observar los reactivos de la ecuación química. En este caso, los reactivos son los ácidos y las bases, y el ácido corresponde a la base conjugada en el lado del producto de la ecuación química; al igual que la base del ácido conjugado en el lado del producto de la ecuación.
Para identificar el ácido conjugado, busque el par de compuestos que están relacionados. La reacción ácido-base se puede ver en un sentido anterior y posterior. El antes es el lado reactivo de la ecuación, el siguiente es el lado del producto de la ecuación. El ácido conjugado en el lado posterior de una ecuación gana un ion de hidrógeno, por lo que en el lado anterior de la ecuación el compuesto que tiene un ion de hidrógeno menos del ácido conjugado es la base. La base conjugada en el lado posterior de la ecuación perdió un ion hidrógeno, por lo que en el lado anterior de la ecuación, el compuesto que tiene un ion hidrógeno más de la base conjugada es el ácido.
Considere la siguiente reacción ácido-base:
- HNO
3 + H
2O → H
3O+
+ NO−
3
Ácido nítrico (HNO
3) es un ácido porque dona un protón a la molécula de agua y su base conjugada es nitrato (NO−
3 ). La molécula de agua actúa como una base porque recibe el Protón de Hidrógeno y su ácido conjugado es el ion hidronio (H
3O+
).
| Ecuación | Ácido | Base | Base Conjugada | Ácido Conjugado |
|---|---|---|---|---|
| HClO 2 + H 2O → ClO− 2 + H 3O+ |
HClO 2 |
H 2O |
ClO− 2 |
H 3O+ |
| ClO− + H 2O → HClO + OH− |
H 2O |
ClO− |
OH− |
HClO |
| HCl + H 2PO− 4 → Cl− + H 3PO 4 |
HCl | H 2PO− 4 |
Cl− |
H 3PO 4 |
Aplicaciones
[editar]Un uso de ácidos y bases conjugados reside en los sistemas de tamponamiento, que incluyen una solución tampón . En un tampón, un ácido débil y su base conjugada (en forma de una sal), o una base débil y su ácido conjugado, se utilizan para limitar el cambio de pH durante un proceso de titulación. Los tampones tienen aplicaciones químicas tanto orgánicas como no orgánicas. Por ejemplo, además de los tampones que se utilizan en los procesos de laboratorio, nuestra sangre actúa como un tampón para mantener el pH. El tampón más importante en nuestro torrente sanguíneo es el tampón de bicarbonato - ácido carbónico, que evita cambios drásticos de pH cuando el CO
2 se introduce. Esto funciona como tal:
Además, aquí hay una tabla de buffers comunes.
Agente tampón pKa Rango de pH útil Ácido cítrico 3.13, 4.76, 6.40 2.1 - 7.4 Ácido acético 4.8 3.8 - 5.8 KH2PO4, 7.2 6.2 - 8.2 CHES 9.3 8.3–10.3 Borato 9.24 8.25 - 10.25
Una segunda aplicación común con un compuesto orgánico sería la producción de un tampón con ácido acético. Si es ácido acético, un ácido débil con la fórmula CH
3COOH, se convirtió en una solución tampón, tendría que combinarse con su base conjugada CH
3COO−
en forma de sal. La mezcla resultante se llama un tampón de acetato, que consiste en CH
3COOH acuoso y CH
3COONa acuoso. El ácido acético, junto con muchos otros ácidos débiles, sirven como componentes útiles de los tampones en diferentes entornos de laboratorio, cada uno útil dentro de su propio rango de pH.
Un ejemplo con un compuesto inorgánico sería el uso medicinal de la base conjugada de ácido láctico conocida como lactato en solución de Ringer lactato y solución de Hartmann . El ácido láctico tiene la fórmula C
3H
6O
6 y su base conjugada se utiliza en fluidos intravenosos que consisten en cationes de sodio y potasio junto con lactato y aniones de cloruro en solución con agua destilada. Estos fluidos son comúnmente isotónicos en relación con la sangre humana y se usan comúnmente para aumentar el nivel de líquido en un sistema después de una pérdida severa de sangre debido a un traumatismo, cirugía o lesión por quemadura.
Tabla de ácidos y sus bases conjugadas
[editar]A continuación se tabulan varios ejemplos de ácidos y sus bases conjugadas; observe cómo difieren en un solo protón (ion H+). La fuerza del ácido disminuye y la fuerza de la base del conjugado aumenta en la tabla.
| Ácido | Base conjugada |
|---|---|
| H 2F+ ion Fluoronio |
HF fluoruro de Hidrógeno |
| HCl ácido Clorhídrico | Cl− ion Cloruro |
| H2SO4 ácido Sulfúrico | HSO4− ion sulfato ácido |
| HNO3 ácido Nítrico | NO−3 ion Nitrato |
| H3O+ ion Hidronio | H2O Agua |
| HSO−4 sulfato ácido | SO4 2− ion Sulfato |
| H3PO4 ácido Fosfórico | H2PO4- ion fosfato diácido |
| CH3COOH ácido Acético | CH3COO− ion Acetato |
| HF ácido Fluorhídrico | F- ion Fluoruro |
| H2CO3 ácido Carbónico | HCO3 − ion Bicarbonato |
| H2S ácido Sulfhídrico | HS− ion sulfuro ácido |
| H2PO4− ion fosfato diácido | HPO4 2− ion fosfato ácido |
| NH+4 ion Amonio | NH3 Amoníaco |
| H2O Agua (pH=7) | OH- ion Hidróxido |
| HCO3− ion carbonato ácido (bicarbonato) de iones de | CO3 2− ionCarbonato |
Tabla de bases y sus ácidos conjugados
[editar]En contraste, aquí hay una tabla de bases y sus ácidos conjugados. De manera similar, la resistencia de la base disminuye y la resistencia del ácido conjugado aumenta en la tabla.
| Base | Ácido conjugado |
|---|---|
| C 2H 5NH 2 Etilamina |
C 2H 5NH+ 3 ion etilamonio |
| CH 3NH 2 Metilamina |
CH 3NH+ 3 ion metilamonio |
| NH 3 Amoníaco |
NH+ 4 ion Amonio |
| C 5H 5N Piridina |
C 5H 6N+ Piridinio |
| C 6H 5NH 2 Anilina |
C 6H 5NH+ 3 ion Fenilamonio |
| C 6H 5CO− 2 ion Benzoato |
C 6H 6CO 2 Benzoico |
| F− ion fluoruro |
HF fluoruro de Hidrógeno |
| PO3−4 ion Fosfato | HPO2−4 ion fosfato ácido |
| OH− ion Hidróxido | H2O Agua (neutro, pH 7) |
Véase también
[editar]Referencias
[editar]- ↑ Zumdahl, Stephen S., & Zumdahl, Susan A. Chemistry. Houghton Mifflin, 2007,
- ↑ "Bronsted-Lowry theory". Encyclopædia Britannica. Encyclopædia Britannica Online. Encyclopædia Britannica Inc., 2015. Web. 21 Apr. 2015<http://www.britannica.com/EBchecked/topic/80953/Bronsted-Lowry-theory>.