Trimetilaluminio
| trimetilaluminio | ||
|---|---|---|
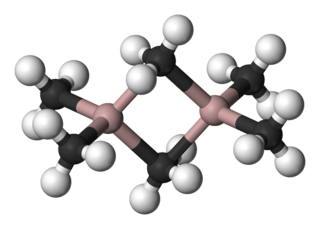 Modelo de bolas | ||
 Fórmula estructural del monómero | ||
| General | ||
| Otros nombres | TMA | |
| Fórmula estructural | Al2(CH3) 6 | |
| Fórmula molecular | C3H18Al2 | |
| Identificadores | ||
| Número CAS | 75-24-1[1] | |
| Propiedades físicas | ||
| Apariencia | transparente | |
| Masa molar | 144,18 g/mol | |
| Punto de fusión | 15 °C (288 K) | |
| Punto de ebullición | 125 °C (398 K) | |
| Peligrosidad | ||
| NFPA 704 |
4
3
3
W
| |
| Riesgos | ||
| Riesgos principales | pirofórico | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El trimetilaluminio es un compuesto químico de fórmula Al2(CH3) 6, abreviado como Al2Me6, (AlMe3)2, o la abreviatura TMA. Es un líquido incoloro pirofórico. Es un compuesto de organoaluminio industrialmente importante. Forma un humo blanco (óxidos de aluminio) cuando el vapor se libera en el aire.
Estructura y enlaces[editar]
El Al2(CH3) 6 existe como un dímero, análogo en estructura y enlaces al diborano. Al igual que el diborano, las moléculas están conectados por 2 enlaces 3-centro-2-electrones : los grupos metil comparte puente entre los dos átomos de aluminio. Las distancias de Al-C (terminal) y Al C-(puente) son 1,97 y 2,14 Å, respectivamente.[2] Los átomos de carbono de los grupos metilo de transición esta cada uno rodeado por cinco vecinos: tres átomos de hidrógeno y dos átomos de aluminio. Los grupos metilo intercambiar fácilmente intramolecularmente y intermolecularmente.
La molécula Al(CH3)3, que costa de un átomo aluminio unido a tres grupos metílicos es desconocido. La teoría RPECV predice que una molécula tendría triple simetría, como se observa en B(CH3)3.
Propiedades químicas[editar]
Puesto que el ion de aluminio está rodeado solo por tres grupos metilo, tiene sólo seis electrones de valencia. Para cumplir la regla del octeto y lograr una configuración de gas noble adopta la configuración de dímero, los dos núcleos de aluminio están puenteados por dos grupos metilo.
Esto permite compararlo con el diborano haciendo corresponder los átomos de aluminio con los de boro y los grupos metilo con los átomos de hidrógeno. Como los núcleos de hidrógeno en el diborano forma los grupos metileno de puente, un enlace de tres centros y dos electrones, cada grupo metilo, proporciona dos electrones. Aunque los átomos de carbono de los grupos metilo del puente esta cada uno rodeado de cinco vecinos, tienen sólo ocho electrones en su capa más externa. Esta situación causa una deficiencia de electrones, lo que hace que sea muy reactivo. El TMA es un ácido de Lewis y reacciona con una variedad de sustancias. Por ejemplo, por tratamiento con aminas de [aducto]s R3N-AlMe3. Otra reacción que da productos que siguen la regla del octeto es la reacción de Al2(CH3) 6 con tricloruro de aluminio para dar (AlMe2 Cl)2. Remplaza rápidamente el grupo metilo por otros grupos o átomos (por ejemplo, halógenos ) que contengan más electrones. Esta propiedad hace que el TMA sea un excelente agente de metilación.
Reacciona violentamente con el agua:
Reacciona con ácidos, alcoholes, aminas y otros compuestos donantes de protones.
Oxida al alcóxido:
Con el dióxido de carbono forma acetato de aluminio:
Síntesis[editar]
El TMA se prepara mediante un proceso de dos pasos que se pueden resumir como sigue:
La reacción del polvo de aluminio con dimetilmercurio:
La reacción de una amalgama de aluminio con yoduro de metilo :
Aplicaciones[editar]
Química[editar]
El TMA se utiliza principalmente para la producción de metilaluminoxano , un activador de catalizadores Ziegler-Natta para la polimerización de olefinas. El TMA también se emplea como agente de metilación. El reactivo Tebbe, que se utiliza para la metilenación de ésteres y cetonas, se prepara a partir de TMA.
El TMA forma un complejo con la amina terciaria DABCO , que es más seguro de manejar que los TMA sí mismo.[3]
En combinación con Cp 2 ZrCl2 (zirconoceno dicloruro), el (CH3) 2 Al-CH $ 3 añade "a través" alquinos para dar especies de vinilo de aluminio que son útiles en la síntesis orgánica en una reacción conocida como carboaluminación.[4]
Semiconductores[editar]
El TMA también se utiliza en la fabricación de semiconductores para crecer de película delgada, de alta constante dieléctrica tales como el Al2O3 a través de los procesos de deposición química de vapor o deposición de capas atómicas .
El TMA es la fuente orgánicametalica preferida de la epitaxia orgánicametalica en fase de vapor (MOVPE) de los semiconductores que contienen compuestos de aluminio, como AlAs, AlN, AIP, ALSB, AlGaAs, AlInGaAs, AlInGaP, AlGaN, AlInGaN, AlInGaNP, etc. Criterios de la calidad del TMA son (a) impurezas elementales, (b) impurezas oxigenadas y orgánicas.
Física atmosférica[editar]
El TMA se libera a menudo desde cohetes sonda como marcador en los estudios de los patrones de viento de la atmósfera superior. La misión de la NASA Atrex (Anomalous Transport Rocket Experiment) emplea el humo blanco que se forma en contacto con el aire TMA para estudiar el flujo de chorro de alta altitud.
Seguridad[editar]
TMA es altamente corrosivo. El compuesto se inflama espontáneamente en el aire y reacciona explosivamente con el agua. Por lo tanto debe ser siempre llevado a cabo en una atmósfera de gas inerte seco.
Referencias[editar]
- ↑ Número CAS
- ↑ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ↑ Biswas, K.; Prieto, O.; Goldsmith, P. J.Woodward, S. (2005). «Remarkably Stable (Me3Al)2DABCO and Stereoselective Nickel-Catalyzed AlR3 (R = Me, Et) Additions to Aldehydes». Angewandte Chemie International Edition 44 (15): 2232-2234. PMID 15768433. doi:10.1002/anie.200462569.
- ↑ "{{{title}}}". Org. Synth.; Coll. Vol. 7: 245.
Bibliografía[editar]
- A. F. Holleman e E. Wiberg (2001). Inorganic chemistry (en inglés). San Diego: Academic Press. ISBN 0-12-352651-5.
- M. R. Mason (2006). «Aluminum: Organometallic Chemistry». Encyclopedia of Inorganic Chemistry (en inglés). Wiley. doi:10.1002/0470862106.ia008.








