Tiofosgeno
| Tiofosgeno | ||
|---|---|---|
  | ||
| Nombre IUPAC | ||
| Tiofosgeno | ||
| General | ||
| Otros nombres |
Cloruro de tiocarbonilo Dicloruro carbonotioico | |
| Fórmula estructural |
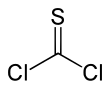 | |
| Fórmula molecular | CSCl2 | |
| Identificadores | ||
| Número CAS | 463-71-8[1] | |
| Número RTECS | XN2450000 | |
| ChEBI | 29366 | |
| ChemSpider | 9645 | |
| PubChem | 10040 | |
| UNII | 067FQP576P | |
|
ClC(=S)Cl
| ||
| Propiedades físicas | ||
| Apariencia | yellow liquid | |
| Densidad | 1500 kg/m³; 1,50 g/cm³ | |
| Masa molar | 11 498 g/mol | |
| Índice de refracción (nD) | 1,548 | |
| Propiedades químicas | ||
| Solubilidad en agua | decomp. | |
| Compuestos relacionados | ||
| Compuestos relacionados |
Fosgeno Dicloruro de azufre Cloruro de tionilo | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El tiofosgeno es un líquido amarillo con la fórmula CSCl2. Es una molécula con una geometría trigonal plana. Hay dos enlaces reactivos C–Cl que permiten que sea utilizada en diversas síntesis orgánicas.
Síntesis del CSCl2[editar]
El CSCl2 se prepara en un proceso de dos pasos de sulfuro de carbono. En el primer paso, el disulfuro de carbono se trata con cloro para dar cloruro de triclorometanosulfenil, CCl3SCl:
- CS2 + 3 Cl2 → CCl3SCl + S2Cl2
La cloración debe controlarse ya que el exceso de cloro convierte el cloruro de triclorometanosulfenilo en tetracloruro de carbono. La destilación al vapor separa el cloruro de triclorometanosulfenilo, un cloruro de sulfenilo poco común, e hidroliza el monocloruro de azufre. La reducción del cloruro de triclorometanosulfenilo produce tiofosgeno:
- CCl3SCl + M → CSCl2 + MCl2
Normalmente, el estaño se utiliza para agente reductor M.
Usos del CSCl2[editar]
El CSCl2 se usa principalmente para preparar compuestos con la conectividad CSX2 donde X = OR, NHR. Estas reacciones proceden a través de intermediarios tales como el CSClX. Bajo ciertas condiciones, se puede convertir aminas primarias en isotiocianatos. El CSCl2 también sirve como dienofilo para dar, después de 5-tiaciclohexeno derivados de la reducción.
Consideraciones de seguridad[editar]
El CSCl2 es considerado altamente tóxico.
Referencias[editar]
Bibliografía[editar]
- Dyson, G. M. Síntesis Orgánica del "Tiofosgeno", Coll. Vol. 1, p. 506; Vol. 6, p. 86.
- Sharma, S. "El tiofosgeno en la síntesis orgánica" Synthesis, 1978, pages 804-820.
Enlaces externos[editar]
- Esta obra contiene una traducción derivada de «Thiophosgene» de Wikipedia en inglés, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.
