Reacciones de alcoholes
Intercambios de grupo funcional
[editar]Oxidaciones
[editar]La oxidación de grupos hidroxilos es una reacción orgánica importante. Los alcoholes primarios (R-CH2-OH) pueden ser oxidados a aldehídos (R-CHO) o ácidos carboxílicos (R-COOH), mientras que la oxidación de alcoholes secundarios (R1R2CH-OH), normalmente termina formando cetonas (R1R2C=O). Los alcoholes terciarios (R1R2R3C-OH) son resistentes a la oxidación.[1]
- a) La oxidación directa de los alcoholes primarios a ácidos carboxílicos: normalmente transcurre a través del correspondiente aldehído, que luego se transforma por reacción con agua en un hidrato de aldehído (R-CH(OH)2), antes de que pueda ser oxidado a ácido carboxílico.
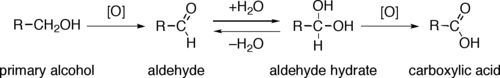
A menudo es posible interrumpir la oxidación de un alcohol primario en el nivel de aldehído mediante la realización de la reacción en ausencia de agua, de modo que no se puedan formar hidratos de aldehído.
- b) Oxidación de alcoholes a aldehídos:

Los reactivos útiles para la transformación de alcoholes primarios en aldehídos normalmente también son adecuados para la oxidación de alcoholes secundarios en cetonas. Estos incluyen:
- Reactivos a base de cromo, tales como reactivo de Collins (CrO3·Py2; donde Py= piridina), PDC o PCC.
- DMSO activado, que resulta de la reacción de DMSO con electrófilos, como el cloruro de oxalilo (oxidación de Swern), una carbodiimida (oxidación de Pfitzner-Moffatt) o el complejo SO3·Py (oxidación de Parikh-Doering).
- Compuestos de yodo hipervalente, como peryodinano de Dess-Martin o el ácido 2-yodoxibenzoico (ácido IBX).
- TPAP catalítico en presencia de un exceso de NMO (oxidación de Ley).
- TEMPO Catalítico en presencia de exceso de lejía (NaOCl) (oxidación de Anelli).
Los alcoholes alílicos y bencílicos pueden ser oxidados en presencia de otros alcoholes con ciertos oxidantes selectivos, tales como dióxido de manganeso (MnO2).
- c) Oxidación de alcoholes a cetonas:
Entre los reactivos útiles para la oxidación de alcoholes secundarios a cetonas, pero por lo general ineficaces para la oxidación de alcoholes primarios a aldehídos, se incluyen el trióxido de cromo (CrO3) en una mezcla de ácido sulfúrico y acetona (oxidación de Jones), y ciertas cetonas, como por ejemplo la ciclohexanona, en presencia de isopropóxido de aluminio (oxidación de Oppenauer). Otro método es la oxidación catalizada por oxoamonio.
- d) Oxidación de alcoholes a ácidos carboxílicos:

La oxidación directa de los alcoholes primarios a ácidos carboxílicos puede llevarse a cabo mediante:
- Permanganato de potasio (KMnO4).
- Oxidación de Jones.
- PDC en DMF.
- Oxidación de Heyns.
- Tetróxido de rutenio (RuO4).
- TEMPO.
- e) Oxidación a dioles:

Los alcoholes que poseen dos grupos hidroxi situados en carbonos adyacentes, es decir, los 1,2-dioles, sufren la ruptura oxidativa de un enlace carbono-carbono con algunos oxidantes como el peryodato de sodio (NaIO4) o el tetraacetato de plomo (Pb(OAc)4), propiciando la generación de dos grupos carbonilo. La reacción también es conocida como ruptura del glicol.[2]
Esterificaciones con ácidos minerales
[editar]Los alcoholes pueden formar ésteres con ácidos inorgánicos (como el ácido sulfúrico, ácido nítrico o ácido fosfórico) o sus respectivos cloruros de acilo (Cloruro de fosforilo, cloruro de sulfurilo o fosgeno)

Biológicamente, las quinasas (EC 2.7.1.-) son enzimas que transfieren grupos fosfato a grupos alcohol:

Formación de halogenuros de alquilo a partir de alcoholes
[editar]
- a)Fluoraciones (X = F): Se pueden obtener fluoruros de alquilo por acción del piridina y fluoruro de hidrógeno (Reactivo de Olah). En vez de fluoruro de hidrógeno pueden ser utilizados varios agentes flourantes, como el trifluoruro de dietilaminoazufre (DAST), SF4, SeF4,TsF, CsI/BF3.[3][4]
- b)Cloraciones (X = Cl): Se pueden obtener cloruros de alquilo por la acción de varios reactivos,[5] tales como ácido clorhídrico (HCl) para alcoholes terciarios y en presencia de cloruro de zinc para alcoholes secundarios y primarios; cloruro de tionilo,[6] cloruro fosfórico (PCl3) cloruro fosforoso (PCl3) y cloruro de fosforilo.[7] El ácido tricloroisocianúrico (1,3,5-triclorohexahidrotriazin-2,4,6-triona) y trifenilfosfina convierten alcoholes primarios en cloruros de alquilo primarios. También se puede reemplazar el grupo hidroxilo por un halógeno en la Reacción de Appel.
- c)Bromaciones (X = Br): Se pueden obtener bromuros de alquilo por la acción de varios reactivos,[5] tales como ácido bromhídrico (HBr), bromuro de tionilo,[6] bromuro fosfórico (PBr3) bromuro fosforoso (PBr3) y bromuro de fosforilo.
- d)Yodaciones (X = I): Se puede emplear ácido yodhídrico, o yoduro de potasio en ácido fosfórico. El uso de HI puede reducir el yoduro de alquilo al alcano correspondiente y si el sustrato es insaturado puede saturarse.[8]
Estas reacciones puede ser utilizadas para preparar halogenuros de alquilo primarios, secundarios y terciarios, pero los alcoholes neopentílicos muchas veces pueden transponer.[9]
Deshidratación de alcoholes
[editar]La deshidratación de alcoholes es el proceso químico que consiste en la transformación de un alcohol para poder ser un alqueno por procesos de eliminación. Para realizar este procedimiento se utiliza un ácido mineral para extraer el grupo hidroxilo (OH) desde el alcohol, generando una carga positiva en el carbono del cual fue extraído el Hidroxilo el cual tiene una interacción eléctrica con los electrones más cercanos (por defecto, electrones de un hidrógeno en el caso de no tener otro sustituyente) que forman un doble enlace en su lugar.
Por esto, la deshidratación de alcoholes es útil, puesto que fácilmente convierte a un alcohol en un alqueno.
Un ejemplo simple es la síntesis del ciclohexeno por deshidratación del ciclohexanol. Se puede ver la acción del ácido (H2SO4) ácido sulfúrico el cual quita el grupo hidroxilo del alcohol, generando el doble enlace y agua.
Se reemplaza el grupo hidroxilo por una halógeno en la Reacción de Appel.
Formación de enlaces C-O-C
[editar]Alquilación de alcoholes
[editar]- 1) Deshidratación de alcoholes
Nombre de acuerdo al sistema de March: Alcoxi-deshidroxilación

La deshidratación de alcoholes para formar éteres simétricos puede llevarse a cabo con un ácido que funcione como deshidratante, tal como el ácido sulfúrico.[10] El mecanismo de reacción consiste en:
- a) Protonación del alcohol
- b) Sustitución nucleófila, dependiendo si el alcohol es primario (Reacción SN2), secundario o terciario (Reacción SN1).
Un mecanismo alternativo propone la formación del monoéster sulfúrico, y así se forma sulfato como grupo saliente. Se pueden mejorar los rendimientos en el caso de diarilcarbinoles (ArAr'CHOH) con ácido tosílico en estado sólido.[11] Otros deshidratantes utilizados puede ser el Nafion con siliéteres,[12] y ácidos de Lewis (p. ejem. MeAl(NTf)2)con algunos alcoholes.[13]
Los 1,4-dioles y los 1,5-dioles forman compuestos heterocíclicos. Los dioles vecinales pueden formar epóxidos:

- 2) Alquilación con diazocompuestos
Nombre de acuerdo al sistema de March: Hidro,alcoxi-desdiazo-bisustitución

Los alcoholes reaccionan con diazocompuestos para formar éteres, pero el diazometano y las diazocetonas reaccionan con mayor facilidad, produciendo así metiléteres o α-cetoéteres respectivamente[14] Con diazometano el método es costoso y requiere precauciones, pero las condiciones son moderadas y tiene altos rendimientos.[15] El diazometano por lo general es utilizado para metilar alcoholes que pueden presentar reacciones indeseadas. Los alcoholes ordinarios reaccionan en presencia de catalizadores tales como HBF4 (HF/BrF3)[16] o sílica gel.[17]
- 3) Alcohólisis de aziridinas y epóxidos
Nombre de acuerdo al sistema de March: (3)OC-seco-alcoxi-desalcoxilación

En esta reacción puede utilizarse ácido sulfúrico, ácido fosfórico, bromuro de flúor y otros ácido de Lewis[18] o alúmina.[19] Puede ocurrir por mecanismo Reacción SN1 o Reacción SN2. También se han reportado catalizadores de [Rh(CO)2Cl]2,[20] TiCl3(OTf)[21] Fe(ClO4)3,[22] Cu(BF4)2.n H2O,[23] o BiCl3.[24]
- 4) Adición de alcoholes a alquenos
Nombre de acuerdo al sistema de March: Hidro-alcoxi-adición

La adición de alcoholes a dobles ligaduras puede ser catalizada por ácidos. El mecanismo es electrofílico, en donde el enlace π es atacado por el protón ácido. Al formarse el carbocatión, el alcohol se adiciona por el mecanismo de SN. La adición sigue la Regla de Markovnikov. Los alcoholes primarios dan mejores resultados que los secundarios y los alcoholes terciarios son muy inactivos. La adición de alcoholes a sistemas alílicos puede proceder con transposición y el uso de un aditivo quiral puede llevar a una inducción asimétrica.[25] La adición intramolecular de alcoholes a alquenos puede ser promovida por un catalizador de paladio, en donde la doble ligadura puede migrar en el producto final.[26] Los compuestos de renio,[27] de titanio[28] o de platino[29] facilitan la ciclización de anillos de tetrahidrofurano. Los alcoholes alílicos se pueden convertir en 2-bromooxetanos empleando Br(colidina)2+ PF6.[30]
Formación de cetales
[editar]Los acetales y cetales se preparan a partir de la acetona o aldehído correspondiente y un alcohol, en presencia de ácido mineral. La reacción está en equilibrio marcado, así que se utilizan condiciones que favorezcan la formación del producto acetálico, por ejemplo, haciendo uso de la ley de acción de masas. El mecanismo de formación de acetales se cataliza con medio ácido. Esta reacción es en dos etapas, llevadas a cabo en el mismo reactor. En la primera, el compuesto carbonílico reacciona con una cantidad equivalente de alcohol, en un equilibrio ácido-base por un mecanismo de adición-eliminación para formar un hemiacetal (o hemicetal, según sea aldehído o cetona). El hemiacetal se protona posteriormente para formar el acetal otra vez por un mecanismo adición-eliminación.

Esterificaciones carboxílicas
[editar]Se denomina esterificación carboxílica al proceso por el cual se sintetiza un éster carboxílico.
- a) Esterificación de Fischer-Speier: La esterificación de Fischer-Speier o esterificación de Fischer es un tipo especial de esterificación que consiste en la formación de un éster por reflujo de un ácido carboxílico y un alcohol, en presencia de un catalizador ácido. La reacción fue descrita por vez primera por Emil Fischer y Arthur Speier en 1895.1 La mayoría de ácidos carboxílicos son aptos para la reacción, pero el alcohol debe ser generalmente un alcohol primario o secundario. Los alcoholes terciarios son susceptibles a la eliminación, y los fenoles suelen ser muy poco reactivos para dar rendimientos útiles. Los catalizadores más comúnmente usados para una esterificación de Fischer incluyen al ácido sulfúrico, ácido tosílico y un ácido de Lewis como el triflato de escandio(III).
- b) Esterificación de Schotten-Bauer:
- c) Esterificación con anhídridos carboxílicos:
- d) Esterificación por carbonilación:
Nombre de acuerdo al sistema de March: Alcoxicarbonil-deshalogenación

Varios métodos, basados en el empleo del monóxido de carbono o carbonilos metálicos, han sido desarrollados por conversión de halogenuros de alquilo en presencia de un alcohol para formar ésteres[31] Las condiciones más empleadas son en presencia de pentacloruro de antimonio y bióxido de azufre. El cloruro de antimonio promueve la formación del carbocatión y el par electrónico del carbeno del monóxido de carbono lo ataca. El alcohol ataca al carbonilo correspondiente.
De manera similar, los alcoholes terciarios reaccionan con H2SO4 y monóxido de carbono para producir ácidos acéticos trisustituidos de acuerdo al procedimiento de Koch-Haaf.[32] Si un alcohol primario o secundario es el sustrato, puede sufrir transposición. Los yodoalcoholes pueden formar lactonas en presencia de iniciadores de radicales libres (AIBN, tributil alil estannano) (Alil-SnBu3) y 45 atm de CO.[33]
La reacción de Mitsunobu es una reacción orgánica que convierte un alcohol en una diversidad de grupos funcionales, tales como un éster, usando trifenilfosfina y azodicarboxilato de dietilo (DEAD).[34] El alcohol sufre una inversión de su estereoquímica.

- e) Formación de carbamatos
Se pueden preparar carbamatos empleando alcoholes y un isociatato de alquilo. Es una reacción de amplio espectro y que produce buenos rendimientos. La adición de un segundi equivalente produce un alofanato.[35]

Formación de enlaces carbono-carbono (C-OH → C-C)
[editar]Acoplamiento de alcoholes con organometálicos
[editar]Nombre de acuerdo al sistema de March: Deshidroxil-acoplamiento

En algunos casos es posible acoplar un alcohol con un compuesto organometálico. Los alcoholes alílicos se acoplan con bromuros de alquilmagnesio en la presencia de tetraisopropóxido de titanio (M = Ti)[36] Los alcoholes alílicos también se pueden acoplar con ácidos arilborónicos solvente iónico líquido y un catalizador de rodio.[37] El acoplamiento de un alcohol al carbono α de una alquilmetilcetona da un alcohol β-sustituido.[38]
Los alcoholes alílicos o bencílicos pueden ser simétricamente acoplados por tratamiento con metil litio y cloruro de titanio (III) a -78 °C o con cloruro de titanio (III) e hidruro de litio y aluminio. Si el sustrato es un alcohol alílico, la reacción no es regioespecífica. Los 1,3-dioles se pueden convertir en ciclopropanos por esta reacción[39][40][41]

Referencias
[editar]- ↑ March, Jerry (1985), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (3ª ed.), Nueva York: Wiley, ISBN 0-471-85472-7
- ↑ http://books.google.es/books?id=KpTfbF6mguAC&pg=PA301 Química orgánica fundamental. Louis Frederick Fieser, Mary Fieser. 4ª edición. Editorial Reverté, 1976. ISBN 8429171614 Pág. 301
- ↑ C. G. Bergstrom et al., J. Org. Chem. 28, 2633 (1963)
- ↑ G. A. Olah et al., Synthesis 1973, 779; idem et al., J. Org. Chem. 44, 3872 (1979).
- ↑ a b Larock, R.C. Comprehensive Organic Transformations, 2nd ed., Wiley-VCH, NY, 1999, pp. 689–697
- ↑ a b Pizey, J.S. Synthetic Reagents, Vol. 1, Wiley, NY, 1974,pp. 321–357
- ↑ Salomaa, P.; Kankaanpera¨, A.; Pihlaja, K., in Patai, S. The Chemistry of the Hydroxyl Group, pt. 1, Wiley, NY, 1971, pt. 1, pp. 595–622
- ↑ Jones, R.; Pattison, J.B. J. Chem. Soc. C (1969) 1046
- ↑ Di Deo, M.; Marcantoni, E.; Torregiani, E.; Bartoli, G.; Bellucci, M. C.; Bosco, M.; Sambri, L. J. Org.Chem. (2000) 65:2830
- ↑ Feuer, H.; Hooz, J., in Patai, S. The Chemistry of the Ether Linkage (1967) Wiley, NY. pp.457–460, 468–470
- ↑ Toda, F.; Takumi, H.; Akehi, M. J. Chem. Soc. Perkin Trans. 2 (1990) p.1270
- ↑ Zolfigol, M.A.; Mohammadpoor-Baltork, I.; Habibi, D.; Mirjalili, B.B.F.; Bamoniri, A. Tetrahedron Lett. (2003) 44:p.8165
- ↑ Ooi, T.; Ichikawa, H.; Itagaki, Y.; Maruoka, K. Heterocycles (2000) 52:575
- ↑ Pansare, S.V.; Jain, R.P.; Bhattacharyya, A. Tetrahedron Lett. (1999) 40:5255
- ↑ Pizey, J.S. Synthetic Reagents (1974) V.2. Wiley, NY, pp. 65–142
- ↑ Neeman, M.; Caserio, M.C.; Roberts, J.D.; Johnson, W.S. Tetrahedron (1959) 6:36
- ↑ Ohno, K.; Nishiyama, H.; Nagase, H. Tetrahedron Lett. (1979) p.4405
- ↑ Iranpoor, N.; Tarrian, T.; Movahedi, Z. Synthesis 1996, 1473
- ↑ Posner, G.H.; Rogers, D.Z. J. Am. Chem. Soc. (1977) 99:8208-8214
- ↑ Fagnou, K.; Lautens, M. Org. Lett. (2000) 2:2319
- ↑ Iranpoor, N.; Zeynizadeh, B. Synth. Commun. (1999) 29:1017.
- ↑ Salehi, P.; Seddighi, B.; Irandoost, M.; Behbahani, F.K. Synth. Commun. (2000) 30:2967
- ↑ Barluenga, J.; Vázquez-Villa, H.; Ballesteros, A.; González, J.M. Org. Lett. (2002) 4:2817
- ↑ Mohammadpoor-Baltork, I.; Tangestaninejad, S.; Aliyan, H.; Mirkhani, V. Synth. Commun. (2000) 30:2365
- ↑ Nakamura, H.; Ishihara, K.; Yamamoto, H. J. Org. Chem. (2002) 67:5124
- ↑ Rönn, M.; Bäckvall, J.-E.; Andersson, P.G. Tetrahedron Lett. (1995) 36:7749
- ↑ Kennedy, R.M.; Tang, S. Tetrahedron Lett. (1992) 33: 3729
- ↑ Lattanzi, A.; Della Sala, G.G.D.; Russo, M.; Screttri, A. Synlett (2001) 1479
- ↑ Qian, H.; Han, X.; Widenhoefer, R.A. J. Am. Chem. Soc. (2004) 126:9536
- ↑ Kang, S.-K.; Baik, T.-G.; Kulak, A.N. Synlett (1999) 324
- ↑ Yoshimura, M.; Nojima, M.; Tokura, N. Bull. Chem. Soc. Jpn. (1973) 46:2164;
- ↑ Bahrmann, H., Falbe, J. New Syntheses with Carbon Monoxide (1980) Springer, NY, pp.372–413
- ↑ Kreimerman, S.; Ryu, I.; Minakata, S.; Komatsu, M. Org. Lett. (2000) 2:38
- ↑ Mitsunobu, O.; Yamada, Y. Bull. Chem. Soc. Japan 1967, 40, 2380-2382.
- ↑ Oh, L.M.; Spoors, P.G.; Goodman, R.M. Tetrahedron Lett. (2004) 45:4769
- ↑ Kulinkovich, O.G.; Epstein, OL.; Isakov, V.E.; Khmel’nitskaya, E.A. Synlett (2001) 49:1497Kabalka,
- ↑ Kabalka, G.W.; Dong, G.; Venkataish, B. Org. Lett. 2003, 5, 893
- ↑ Cho, C.S.; Kim, B.T.; Kim. T.-J.; Shim. S.C. J. Org. Chem. 2001, 66, 9020.
- ↑ Sharpless, K.B.; Hanzlik, R.P.; van Tamelen, E.E. J. Am. Chem. Soc. (1968) 90:209
- ↑ McMurry, J.E.; Silvestri, M.G.; Fleming, M.P.; Hoz, T.; Grayston, M.W. J. Org. Chem. (1978) 43:3249
- ↑ Nakanishi, S.; Shundo, T.; Nishibuchi, T.; Otsuji, Y. Chem. Lett. (1979) 955
