Reacción de Johnson-Corey-Chaykovsky
La reacción de Johnson-Corey-Chaykovsky (a veces denominada reacción Corey-Chaykovsky o RCC) es una reacción química utilizada en química orgánica para la síntesis de epóxidos, aziridinas y ciclopropanos. Fue descubierta en 1961 por A. William Johnson y desarrollada significativamente por E. J. Corey y Michael Chaykovsky. La reacción consiste en la adición de un iluro de azufre a una cetona, aldehído, imina o enona para producir el anillo de 3 miembros correspondiente. La reacción es diastereoselectiva y favorece la sustitución trans en el producto, independientemente de la estereoquímica inicial. La síntesis de epóxidos mediante este método constituye una importante alternativa retrosintética a las reacciones tradicionales de epoxidación de olefinas.

La reacción se emplea con mayor frecuencia para la epoxidación mediante transferencia de metileno, y con este fin se ha utilizado en varias síntesis totales notables (véase Síntesis de epóxidos más adelante). A continuación se detallan la historia, el mecanismo, el alcance y las variantes enantioselectivas de la reacción. Se han publicado varias revisiones.[1][2][3][4][5][6]
Historia
[editar]La publicación original de Johnson se refería a la reacción del fluoreniluro de 9-dimetilsulfonio con derivados de benzaldehído sustituidos. El intento de reacción tipo Wittig fracasó y en su lugar se obtuvo un óxido de benzalfluoreno, observándose que «la reacción entre el ilido de azufre y los benzaldehídos no produjo benzalfluorenos como había ocurrido con los ilidos de fósforo y arsénico».[7]

El desarrollo posterior del (dimetiloxosulfaniumil)metanuro, (CH3)2SOCH2 y del (dimetilsulfaniumil)metanuro, (CH3)2SCH2 (conocidos como reactivos Corey-Chaykovsky) por Corey y Chaykovsky como reactivos eficientes de transferencia de metileno estableció la reacción como parte del canon orgánico.[8]

Mecanismo
[editar]El mecanismo de reacción para la reacción Johnson-Corey-Chaykovsky consiste en la adición nucleofílica del iluro al grupo carbonilo o imina. Se transfiere una carga negativa al heteroátomo y, como el catión de sulfonio es un buen grupo saliente, se expulsa formando el anillo. En la reacción de Wittig relacionada, la formación del doble enlace fósforo-oxígeno, mucho más fuerte, impide la formación del oxirano y, en su lugar, la olefinación tiene lugar a través de un intermediario cíclico de 4 miembros.[4][9]

La diastereoselectividad trans observada se debe a la reversibilidad de la adición inicial, que permite el equilibrio de la betaína anti favorecida sobre la betaína syn. La adición inicial de la iluro da lugar a una betaína con cargas adyacentes; los cálculos de la teoría del funcional de la densidad han demostrado que el paso que limita la velocidad es la rotación del enlace central en el conformador necesario para el ataque por la parte posterior del sulfonio.[1]

El grado de reversibilidad en el paso inicial (y por tanto la diastereoselectividad) depende de cuatro factores, correspondiendo una mayor reversibilidad a una mayor selectividad:[1]
- La estabilidad del sustrato con mayor estabilidad conduce a una mayor reversibilidad favoreciendo el material de partida sobre la betaína.
- La estabilidad de la iluro con mayor estabilidad conduce igualmente a una mayor reversibilidad.
- El impedimento estérico en la betaína con un mayor impedimento conduce a una mayor reversibilidad al desfavorecer la formación del intermediario y ralentizar la rotación limitadora de la velocidad del enlace central.
- La solvatación de las cargas en la betaína por contraiones como el litio con una mayor solvatación permite una rotación más fácil en la betaína intermedia, disminuyendo la cantidad de reversibilidad.
Alcance
[editar]La aplicación de la reacción de Johnson-Corey-Chaykovsky en síntesis orgánica es diversa. La reacción ha llegado a abarcar reacciones de muchos tipos de iluros de azufre con electrófilos mucho más allá de las publicaciones originales. Se ha utilizado en una serie de síntesis totales de alto perfil, como se detalla a continuación, y se reconoce generalmente como una poderosa herramienta de transformación en el repertorio orgánico.
Tipos de iluros
[editar]Pueden prepararse muchos tipos de iluros con diversos grupos funcionales tanto en el centro aniónico de carbono como en el azufre. El patrón de sustitución puede influir de diversas maneras en la facilidad de preparación de los reactivos (normalmente a partir del haluro de sulfonio, por ejemplo, yoduro de trimetilsulfonio) y en la velocidad de reacción global. El formato general del reactivo se muestra a la derecha.[1]
El uso de un sulfoxonio permite una preparación más sencilla del reactivo utilizando bases más débiles en comparación con los iluros de sulfonio. (La diferencia es que un sulfoxonio contiene un oxígeno doblemente enlazado mientras que el sulfonio no). Los primeros reaccionan más lentamente debido a su mayor estabilidad. Además, los subproductos de dialquilsulfóxido de los reactivos de sulfoxonio son preferibles a los subproductos de dialquilsulfuro de los reactivos de sulfonio, que son mucho más tóxicos, volátiles y olorosos.[1]
La gran mayoría de los reactivos están monosustituidos en el carbono de la iluro (ya sea R1 o R2 como hidrógeno). Los reactivos disustituidos son mucho más raros, pero se han descrito:[1]
- Si el carbono del iluro está sustituido por un grupo que retira electrones (EWG), el reactivo se denomina iluro estabilizado. Éstos, al igual que los reactivos de sulfoxonio, reaccionan mucho más lentamente y suelen ser más fáciles de preparar. Su utilidad es limitada, ya que la reacción puede llegar a ser prohibitivamente lenta: los ejemplos con amidas están muy extendidos, con muchos menos ejemplos con ésteres y prácticamente ninguno con otros EWG. Para éstos, la condensación de Darzens suele ser más apropiada.
- Si el carbono del iluro está sustituido por un grupo arilo o alilo, el reactivo se denomina iluro semiestabilizado. Estos reactivos se han desarrollado mucho, sólo superados por los reactivos de metileno clásicos (R1=R2=H). El patrón de sustitución en los reactivos de arilo puede influir mucho en la selectividad de la reacción según los criterios anteriores.
- Si el carbono de la iluro está sustituido por un grupo alquilo, el reactivo se denomina iluro no estabilizado. El tamaño de los grupos alquilo es el principal factor de selectividad con estos reactivos.
Los grupos R en el azufre, aunque típicamente metilos, se han utilizado para sintetizar reactivos que pueden realizar variantes enantioselectivas de la reacción (Ver Variaciones más abajo). El tamaño de los grupos también puede influir en la diastereoselectividad en sustratos alicíclicos.[1]
Síntesis de epóxidos
[editar]Las reacciones de iluros de azufre con cetonas y aldehídos para formar epóxidos son, con diferencia, la aplicación más común de la reacción de Johnson-Corey-Chaykovsky. Se han descrito ejemplos en los que intervienen sustratos complejos e iluros «exóticos», como se muestra a continuación.[10][11]


La reacción se ha utilizado en varias síntesis totales notables, como la síntesis total del taxol de Danishefsky, que produce el fármaco quimioterapéutico taxol, y la síntesis total de la estricnina de Kuehne, que produce el pesticida estricnina.[12][13]


Síntesis de aziridinas
[editar]La síntesis de aziridinas a partir de iminas es otra aplicación importante de la reacción de Johnson-Corey-Chaykovsky y proporciona una alternativa a la transferencia de aminas a partir de oxaziridinas. Aunque menos aplicada, la reacción tiene un alcance de sustrato y una tolerancia de grupo funcional similares a la del equivalente carbonílico. Los ejemplos que se muestran a continuación son representativos; en estos últimos, se forma una aziridina in situ y se abre mediante ataque nucleofílico para formar la amina correspondiente.[3][10]
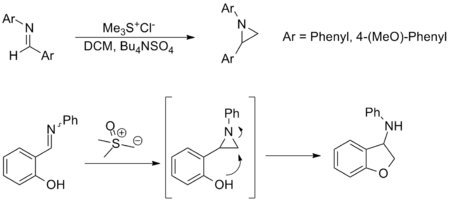
Síntesis de ciclopropanos
[editar]Para la adición de iluros de azufre a enonas, suele obtenerse una mayor selectividad 1,4 con reactivos de sulfoxonio que con reactivos de sulfonio. Una explicación basada en la teoría ABDB afirma que se debe a que los reactivos de sulfoxonio tienen una carga negativa menos concentrada en el átomo de carbono (más blanda), por lo que prefiere el ataque 1,4 en el sitio nucleofílico más blando. Otra explicación apoyada por estudios de teoría funcional de la densidad (DFT) sugiere que un ataque irreversible de 1,4 que lleva al ciclopropano es energéticamente favorecido frente a un ataque reversible de 1,2 que llevaría al epóxido.[14] Con sistemas conjugados extendidos, la adición de 1,6 tiende a predominar sobre la adición de 1,4.[3][10] Se ha demostrado que muchos grupos que retiran electrones promueven la ciclopropanación incluyendo cetonas, ésteres, amidas (el ejemplo de abajo involucra una amida de Weinreb), sulfonas, grupos nitro, fosfonatos, isocianidas e incluso algunos heterociclos deficientes en electrones.[15]

Otras reacciones
[editar]Además de las reacciones originalmente descritas por Johnson, Corey y Chaykovsky, los ylides de azufre se han utilizado para una serie de reacciones de homologación relacionadas que tienden a agruparse bajo el mismo nombre.
- Con epóxidos y aziridinas la reacción sirve como expansión en anillo para producir el oxetano o la azetidina correspondientes. Los largos tiempos de reacción requeridos para estas reacciones impiden que se produzcan como reacciones secundarias significativas al sintetizar epóxidos y aziridinas.[10]

- Se han descrito varias cicloadiciones en las que la iluro actúa como «equivalente nucleófilo del carbenoide».[10]

- Se han descrito polimerizaciones vivas utilizando trialquil boranos como catalizador y (dimetiloxosulfaniumil)metanuro como monómero para la síntesis de diversos polímeros complejos.[16]

Variaciones enantioselectivas
[editar]El desarrollo de una variante enantioselectiva (es decir, que produzca un exceso enantiomérico, lo que se denomina «ee») de la reacción de Johnson-Corey-Chaykovsky sigue siendo un área activa de investigación académica. El uso de sulfuros quirales de forma estequiométrica ha demostrado tener más éxito que las variantes catalíticas correspondientes, pero el alcance del sustrato sigue siendo limitado en todos los casos. Las variantes catalíticas se han desarrollado casi exclusivamente con fines enantioselectivos; los reactivos organosulfurados típicos no son prohibitivamente caros y las reacciones racémicas pueden llevarse a cabo con cantidades equimolares de yluro sin elevar los costes de forma significativa. Los sulfuros quirales, en cambio, son más costosos de preparar, lo que ha impulsado el avance de los métodos catalíticos enantioselectivos.[2]
Reactivos estequiométricos
[editar]A continuación se muestran los reactivos empleados con más éxito de forma estequiométrica. El primero es un oxatiano bicíclico que se ha empleado en la síntesis del compuesto β-adrenérgico dicloroisoproterenol (DCI), pero está limitado por la disponibilidad de un solo enantiómero del reactivo. La síntesis del diastereómero axial se racionaliza mediante el efecto 1,3-anomérico que reduce la nucleofilia del par solitario ecuatorial. La conformación de la ylida está limitada por la tensión transanular y la aproximación del aldehído está limitada a una cara del iluro por interacciones estéricas con los sustituyentes metilo.[2][5]

El otro reactivo principal es un reactivo derivado del alcanfor desarrollado por Varinder Aggarwal, de la Universidad de Bristol. Ambos enantiómeros se sintetizan fácilmente, aunque los rendimientos son inferiores a los del reactivo oxatiano. La conformación del iluro viene determinada por la interacción con los hidrógenos de la cabeza de puente y la aproximación del aldehído está bloqueada por la fracción de alcanfor. La reacción emplea una base fosfazeno para promover la formación del iluro.[2][5]

Reactivos catalíticos
[editar]Los reactivos catalíticos han tenido menos éxito, ya que la mayoría de las variaciones presentan un bajo rendimiento, una escasa enantioselectividad, o ambas cosas. También hay problemas con el alcance del sustrato, ya que la mayoría tienen limitaciones con la transferencia de metileno y los aldehídos alifáticos. El problema radica en la necesidad de un sulfuro nucleófilo que genere eficientemente el iluro y que también pueda actuar como un buen grupo saliente para formar el epóxido. Dado que los factores que subyacen a estos desiderata están reñidos, el ajuste de las propiedades del catalizador ha resultado difícil. A continuación se muestran varios de los catalizadores más exitosos junto con los rendimientos y el exceso enantiomérico para su uso en la síntesis de óxido de (E)-estilbeno.[2][5]

Aggarwal ha desarrollado un método alternativo que emplea el mismo sulfuro que el anterior y una alquilación novedosa en la que interviene un carbenoide de rodio formado in situ. El método también tiene un alcance de sustrato limitado, ya que no funciona con ningún electrófilo que posea sustituyentes básicos debido al consumo competitivo del carbenoide.[2]

Véase también
[editar]Referencias
[editar]- ↑ a b c d e f g Aggarwal, V. K.; Richardson, J. (2003). «"The complexity of catalysis: origins of enantio- and diastereocontrol in sulfur ylide mediated epoxidation reactions"». Chemical Communications. PMID 14649793. doi:10.1039/b304625g.
- ↑ a b c d e f Aggarwal, V. K.; Winn, C. L. (2004). «"Catalytic, Asymmetric Sulfur Ylide-Mediated Epoxidation of Carbonyl Compounds: Scope, Selectivity, and Applications in Synthesis".». Accounts of Chemical Research. PMID 15311960. doi:10.1021/ar030045f.
- ↑ a b c Gololobov, Y. G.; Nesmeyanov, A. N.; lysenko, V. P.; Boldeskul, I. E. (1987). «"Twenty-five years of dimethylsulfoxonium ethylide (corey's reagent)".». Tetrahedron. doi:10.1016/s0040-4020(01)86869-1.
- ↑ a b Li, A.-H.; Dai, L.-X.; Aggarwal, V. K. (1997). «"Asymmetric Ylide Reactions: Epoxidation, Cyclopropanation, Aziridination, Olefination, and Rearrangement".». Chemical Reviews. PMID 11848902. doi:10.1021/cr960411r.
- ↑ a b c d Aggarwal, Varinder K.; Ford, J. Gair; Fonguerna, Sílvia; Adams, Harry; Jones, Ray V. H.; Fieldhouse, Robin (1998). «"Catalytic Asymmetric Epoxidation of Aldehydes. Optimization, Mechanism, and Discovery of Stereoelectronic Control Involving a Combination of Anomeric and Cieplak Effects in Sulfur Ylide Epoxidations with Chiral 1,3-Oxathianes".». Journal of the American Chemical Society. doi:10.1021/ja9812150.
- ↑ McGarrigle, E. M.; Myers, E. L.; Illa, O.; Shaw, M. A.; Riches, S. L.; Aggarwal, V. K. (2007). «"Chalcogenides as Organocatalysts"». Chemical Reviews. PMID 18072810. doi:10.1021/cr068402y.
- ↑ Johnson, A.W.; LaCount, R.B. (1961). «"The Chemistry of Ylids. VI. Dimethylsulfonium Fluorenylide—A Synthesis of Epoxides"». J. Am. Chem. Soc. doi:10.1021/ja01463a040.
- ↑ Corey, E. J.; Chaykovsky, M. (1965). «"Dimethyloxosulfonium Methylide ((CH3)2SOCH2) and Dimethylsulfonium Methylide ((CH3)2SCH2). Formation and Application to Organic Synthesis".». J. Am. Chem. Soc. doi:10.1021/ja01084a034.
- ↑ Kawashima, T.; Okazaki, R. (1996). «"Synthesis and Reactions of the Intermediates of the Wittig, Peterson, and their Related Reactions"». Synlett. doi:10.1055/s-1996-5540.
- ↑ a b c d e Li, Jie Jack (27 de diciembre de 2004). Name Reactions in Heterocyclic Chemistry (en inglés). Wiley. ISBN 978-0-471-70414-0. Consultado el 4 de octubre de 2024.
- ↑ Mundy, Bradford P.; Ellerd, Michael G.; Jr, Frank G. Favaloro (20 de mayo de 2005). Name Reactions and Reagents in Organic Synthesis (en inglés). Wiley. ISBN 978-0-471-73986-9. Consultado el 4 de octubre de 2024.
- ↑ Danishefsky, S. J.; Masters, J. J.; Young, W. B.; Link, J. T.; Snyder, L. B.; Magee, T. V.; Jung, D. K.; Isaacs, R. C. A.; Bornmann, W. G.; Alaimo, C. A.; Coburn, C. A.; Di Grandi, M. J. (1996). «"Total Synthesis of Baccatin III and Taxol"». Journal of the American Chemical Society. doi:10.1021/ja952692a.
- ↑ Kuehne, M. E.; Xu, F. (1993). «"Total synthesis of strychnan and aspidospermatan alkaloids. 3. The total synthesis of (.+-.)-strychnine"». The Journal of Organic Chemistry. doi:10.1021/jo00078a030.
- ↑ Xiang, Yu; Fan, Xing; Cai, Pei‐Jun; Yu, Zhi‐Xiang (23 de enero de 2019). «Understanding Regioselectivities of Corey–Chaykovsky Reactions of Dimethylsulfoxonium Methylide (DMSOM) and Dimethylsulfonium Methylide (DMSM) toward Enones: A DFT Study». European Journal of Organic Chemistry (en inglés) 2019 (2-3): 582-590. ISSN 1434-193X. doi:10.1002/ejoc.201801216. Consultado el 4 de octubre de 2024.
- ↑ Beutner, Gregory L.; George, David T. (20 de enero de 2023). «Opportunities for the Application and Advancement of the Corey–Chaykovsky Cyclopropanation». Organic Process Research & Development (en inglés) 27 (1): 10-41. ISSN 1083-6160. doi:10.1021/acs.oprd.2c00315. Consultado el 4 de octubre de 2024.
- ↑ Luo, J.; Shea, K. J. (2010). «"Polyhomologation. A Living C1 Polymerization"». Accounts of Chemical Research. PMID 20825177. doi:10.1021/ar100062a.
