Propano
| Propano | ||
|---|---|---|
 Modelo 3d del propano. | ||
 | ||
| Nombre IUPAC | ||
| Propano | ||
| General | ||
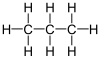
| Fórmula semidesarrollada | CH3CH2CH3 | |
| Fórmula estructural |
 | |
| Fórmula molecular | C3H8 | |
| Identificadores | ||
| Número CAS | 74-98-6[1] | |
| Número RTECS | TX2275000 | |
| ChEBI | 32879 | |
| ChEMBL | CHEMBL135416 | |
| ChemSpider | 6094 | |
| PubChem | 24878140 | |
| UNII | T75W9911L6 | |
| Propiedades físicas | ||
| Apariencia | Incoloro | |
| Densidad | 1,83 kg/m³; 0,00183 g/cm³ | |
| Masa molar | 44 g/mol | |
| Punto de fusión | 85,5 K (−188 °C) | |
| Punto de ebullición | 231,05 K (−42 °C) | |
| Temperatura crítica | 367,15 K (94 °C) | |
| Viscosidad | 0.2 cP (-40 ºC) | |
| Índice de refracción (nD) | 1.3407 (-42 ºC) | |
| Propiedades químicas | ||
| Solubilidad en agua | 80 mg/l a 20 °C | |
| Momento dipolar | 0.08 D | |
| Termoquímica | ||
| ΔfH0gas | -104.7±0.50 kJ/mol | |
| ΔfH0líquido | -119.8 ± 0.59 kJ/mol | |
| S0líquido, 1 bar | 171.0 J·mol–1·K–1 | |
| Peligrosidad | ||
| Punto de inflamabilidad | 169,15 K (−104 °C) | |
| NFPA 704 |
4
2
0
| |
| Temperatura de autoignición | 813,1 K (540 °C) | |
| Frases R |
Error en la cita: Etiqueta <ref> no válida; el nombre no puede ser un número entero. Usa un título descriptivo | |
| Frases S | S2, S9, S16, | |
| Riesgos | ||
| Inhalación | Somnolencia y pérdida del conocimiento. Llevar al accidentado inmediatamente a un sitio al aire libre y mantenerlo en reposo. Respiración artificial si éste estuviese indicado. Proporcionar asistencia médica | |
| Piel | En contacto con líquido: congelación. En caso de congelación, aclarar con abundante agua. No se debe quitar la ropa. Proporcionar asistencia médica | |
| Ojos | En contacto con líquido: congelación. En caso de congelación, enjuagar con abundante agua por varios minutos. Proporcionar asistencia médica | |
| Compuestos relacionados | ||
| Alcanos | Butano, Pentano, Metilpropano | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El propano (del griego pro primer orden y pion grasa, y el sufijo químico -ano dado que es el primero en los ácidos grasos) es un gas incoloro e inodoro. Pertenece a los hidrocarburos alifáticos con enlaces simples de carbono, conocidos como alcanos. Su fórmula química es C3H8.
Generales
Las mezclas de propano con el aire pueden ser explosivas con concentraciones del 1,8 al 9,3 % Vol de propano. La llama del propano, al igual que la de los demás gases combustibles, debe de ser completamente azul; cualquier parte amarillenta, anaranjada o rojiza de la misma, denota una mala combustión. A temperatura ambiente, es inerte frente a la mayor parte de los reactivos aunque reacciona por ejemplo con el bromo en presencia de luz. En elevadas concentraciones el propano tiene propiedades narcotizantes.
Historia
El propano se identificó como componente volátil en la gasolina por el Dr. Walter O. Snelling de la oficina de minas de EE.UU. en 1910. Debido a la volatilidad de estos hidrocarburos ligeros, fueron conocidos como "salvajes" ("wild" en inglés) por la gran presión de vapor en la gasolina no refinada. El 31 de marzo, el New York Times informó sobre el trabajo con gas licuado del Dr. Snelling y que "... una botella de acero de este gas será suficiente para alumbrar un hogar común durante tres semanas.
Fue durante este tiempo que Snelling, en colaboración con Frank P. Peterson, Kerr Chester, y Kerr Arthur, crearon formas para licuar los gases LP durante la refinación de la gasolina natural. Juntos fundaron americano Gasol Co., el primer vendedor de propano comercial. Snelling había producido propano relativamente puro en 1911, y 25 de marzo de 1913 su método de procesamiento y producción de gases LP se otorgó la patente # 1.056.845. Un método aparte de la producción de gas LP a través de la compresión fue creado por Frank Peterson y patentado en 1912 .
La década de 1920 vio a una mayor producción de gas LP, con el primer año de producción registró un total de 223.000 galones (840 m3) en 1922. En 1927, la producción anual comercializada de gas LP alcanzó 1 millón de galones (3.800 m3), y para 1935, las ventas anuales habían llegado a 56 millones de galones estadounidenses (210.000 m3). Las principales novedades de la industria en la década de 1930 incluyeron la introducción del carro tanque de transporte, odorización del gas, y la construcción de plantas locales de llenado de botellas. El año 1945 marcó el primero en el que las ventas anuales alcanzaron los mil millones de galones. Para 1947, el 62% de los hogares de Estados Unidos habían sido equipados con gas natural o propano para cocinar.
En 1950, la Autoridad de Tránsito de Chicago, ordenó 1.000 autobuses a propano y en 1958, las ventas en EE.UU. habían alcanzado 7 mil millones de galones estadounidenses (26 millones m3) anuales. En 2004 se informó de un incremento desde 8 mil millones a 10 mil millones, con unos 15 mil millones de galones estadounidenses (57 millones m3) de gas propano utilizados anualmente en los EE.UU.
La raíz "prop-" en su nombre y los de otros compuestos con cadenas de tres carbonos se derivan del "ácido propiónico".
Presión de vapor
Presión de vapor del propano en función de la temperatura:
| Temperatura (°C) | Presión (Pa) |
|---|---|
| 80 | 1 765 197 |
| 40 | 1 287 123 |
| 30 | 1 103 248 |
| 15 | 735 499 |
| 0 | 490 333 |
| -10 | 372 653 |
| -20 | 269 683 |
| -30 | 184 365 |
| -40 | 122 583 |
Síntesis
El propano se suele obtener del gas natural o de los gases de los procesos de "cracking" producidos en las instalaciones petroquímicas.
Usos
El principal uso del propano es el aprovechamiento energético como combustible. Con base al punto de ebullición más bajo que el butano y el mayor valor energético por gramo, a veces se mezcla con éste o se utiliza propano en vez de butano. En la industria química es uno de los productos de partida en la síntesis del propeno. Además se utiliza como gas refrigerante (R290) o como gas propulsor en aerosoles.
Véase también
Enlaces externos
 Wikimedia Commons alberga una galería multimedia sobre Propano.
Wikimedia Commons alberga una galería multimedia sobre Propano.- Instituto nacional de Seguridad e Higiene en el Trabajo de España: Ficha internacional de seguridad química del propano.

