Polímero de coordinación

Un polímero de coordinación es una estructura polimérica inorgánica u organometálica que contiene centros de cationes metálicos unidos por ligandos. Más formalmente, un polímero de coordinación es un compuesto de coordinación con entidades de coordinación repetitivas que se extienden en 1, 2 o 3 dimensiones.[1]
También puede describirse como un polímero cuyas unidades de repetición son complejos de coordinación. Los polímeros de coordinación contienen la subclase de redes de coordinación que son compuestos de coordinación que se extienden, a través de entidades de coordinación repetidas, en 1 dimensión, pero con enlaces cruzados entre dos o más cadenas individuales, bucles o espiroenlaces, o un compuesto de coordinación que se extiende a través de entidades de coordinación repetidas en 2 o 3 dimensiones. Una subclase de éstos son los marcos metalorgánicos, o MOF, que son redes de coordinación con ligandos orgánicos que contienen huecos potenciales.[1]
Los polímeros de coordinación son relevantes para muchos campos y tienen muchas aplicaciones potenciales.[2]
Los polímeros de coordinación pueden clasificarse de varias maneras en función de su estructura y composición. Una clasificación importante es la dimensionalidad. Se puede determinar que una estructura es unidimensional, bidimensional o tridimensional, dependiendo del número de direcciones en el espacio en las que se extienda el conjunto. Una estructura unidimensional se extiende en línea recta (a lo largo del eje x); una estructura bidimensional se extiende en un plano (dos direcciones, ejes x e y); y una estructura tridimensional se extiende en las tres direcciones (ejes x, y y z).[3] Esto se representa en la figura 1.
Historia[editar]
El trabajo de Alfred Werner y sus contemporáneos sentaron las bases del estudio de los polímeros de coordinación. Hoy en día, muchos materiales tradicionales se consideran polímeros de coordinación. Por ejemplo, los complejos de cianuro azul de Prusia y clatratos de Hofmann.[4]
Síntesis y propagación[editar]
Los polímeros de coordinación a menudo se preparan por autoensamblaje, lo que implica la cristalización de una sal metálica con un ligando. Los mecanismos de ingeniería de cristales y autoensamblaje molecular son relevantes.[2]

Fuerzas intermoleculares y enlace.[editar]
Las fuerzas que determinan los complejos metal-ligando incluyen las fuerzas de van der Waals, las interacciones pi-pi, los enlaces de hidrógeno y la estabilización de los enlaces pi mediante enlaces polarizados, además del enlace de coordinación formado entre el metal y el ligando. Estas fuerzas intermoleculares tienden a ser débiles, con una distancia de equilibrio larga (longitud de enlace) en comparación con los enlaces covalentes. Las interacciones pi-pi entre anillos de benceno, por ejemplo, tienen una energía de aproximadamente 5 a 10 kJ/mol y una separación óptima de 3,4 a 3,8 Ångstroms entre las caras paralelas de los anillos.
Coordinación[editar]
La estructura cristalina y la dimensionalidad del polímero de coordinación vienen determinadas por la funcionalidad del enlazador y la geometría de coordinación del centro metálico. Por lo general, la dimensionalidad viene determinada por el centro metálico, que puede tener la capacidad de unirse a hasta 16 sitios funcionales en los enlazadores; sin embargo, esto no siempre es así, ya que la dimensionalidad puede venir determinada por el enlazador cuando éste se une a más centros metálicos que el centro metálico a los enlazadores.[5] El mayor número de coordinación conocido de un polímero de coordinación es 14,[6] aunque los números de coordinación se sitúan con mayor frecuencia entre 2 y 10.[7] En la Figura 2 se muestran ejemplos de varios números de coordinación en geometría plana. En la Figura 1, la estructura 1D es de 2 coordinaciones, la planar es de 4 coordinaciones y la 3D es de 6 coordinaciones.
Centros metálicos[editar]
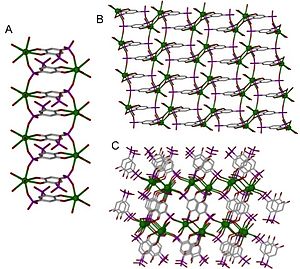
A. [Ca(L)(H2O)4 ]•H2O
B. [Sr(L)(H2O)4]•H2O
C. [Ba(L)(H2O)]• H2O[8]
En cada caso, el metal se representa en verde.
Los centros metálicos, a menudo denominados nodos o cubos, se unen a un número específico de enlazadores en ángulos bien definidos. El número de enlazadores unidos a un nodo se conoce como número de coordinación, que, junto con los ángulos en los que se mantienen, determina la dimensionalidad de la estructura. El número de coordinación y la geometría de coordinación de un centro metálico vienen determinados por la distribución no uniforme de la densidad electrónica a su alrededor y, en general, el número de coordinación aumenta con el tamaño del catión. Varios modelos, entre los que destacan el modelo de hibridación y la teoría de orbitales moleculares, utilizan la ecuación de Schrödinger para predecir y explicar la geometría de coordinación; sin embargo, esto resulta difícil en parte debido al complejo efecto del entorno sobre la distribución de la densidad electrónica.[9]
Metales de transición[editar]
Los metales de transición se usan comúnmente como nodos. Los orbitales d parcialmente llenos, ya sea en el átomo o en el ion, pueden hibridarse de manera diferente según el entorno. Esta estructura electrónica hace que algunos de ellos muestren múltiples geometrías de coordinación, en particular los iones de cobre y oro que, como átomos neutros, tienen orbitales d completos en sus capas externas.
Lantánidos[editar]
Los lantánidos son átomos grandes con números de coordinación que varían de 7 a 14. Su entorno de coordinación puede ser difícil de predecir, lo que dificulta su uso como nodos. Ofrecen la posibilidad de incorporar componentes luminiscentes.
Metales alcalinos y metales alcalinotérreos[editar]
Los metales alcalinos y los metales alcalinotérreos existen como cationes estables. Los metales alcalinos forman fácilmente cationes con capas de valencia estables, lo que les otorga un comportamiento de coordinación diferente al de los lantánidos y los metales de transición. Se ven fuertemente afectados por el contraión de la sal utilizada en la síntesis, que es difícil de evitar. Los polímeros de coordinación que se muestran en la Figura 3 son todos metales del grupo dos. En este caso, la dimensionalidad de estas estructuras aumenta a medida que el radio del metal aumenta hacia abajo en el grupo (del calcio al estroncio y al bario).
Ligandos[editar]
En la mayoría de los polímeros de coordinación, un ligando (átomo o grupo de átomos) donará formalmente un par solitario de electrones a un catión metálico y formará un complejo de coordinación mediante una relación ácido/base de Lewis (ácidos y bases de Lewis). Los polímeros de coordinación se forman cuando un ligando tiene la capacidad de formar múltiples enlaces de coordinación y actuar como puente entre múltiples centros metálicos. Los ligandos que pueden formar un enlace de coordinación se denominan monodentados, pero los que forman enlaces de coordinación múltiples, que podrían dar lugar a polímeros de coordinación, se denominan polidentados. Los ligandos polidentados son especialmente importantes porque es a través de los ligandos que conectan múltiples centros metálicos entre sí como se forma un conjunto infinito. Los ligandos polidentados también pueden formar enlaces múltiples con el mismo metal (lo que se denomina quelación). Los ligandos monodentados también se denominan terminales porque no ofrecen un lugar para que la red continúe. A menudo, los polímeros de coordinación constan de una combinación de ligandos polidentados y monodentados, de puente, quelantes y terminales.
Composición química[editar]
Casi cualquier tipo de átomo con un solo par de electrones puede incorporarse a un ligando. Los ligandos que se encuentran comúnmente en los polímeros de coordinación incluyen polipiridinas, fenantrolinas, hidroxiquinolinas y policarboxilatos. Los átomos de oxígeno y nitrógeno se encuentran comúnmente como sitios de unión, pero se han observado otros átomos, como el azufre[10] y el fósforo,[11][12].
Los ligandos y los cationes metálicos tienden a seguir las tendencias de la teoría de la base ácida blanda dura ( HSAB ). Esto significa que los metales blandos más grandes y polarizables se coordinarán más fácilmente con ligandos blandos más grandes y polarizables, y que los metales duros pequeños y no polarizables se coordinarán con ligandos duros pequeños y no polarizables.
Orientación estructural[editar]

Los ligandos pueden ser flexibles o rígidos. Un ligando rígido es aquel que no tiene libertad para rotar alrededor de los enlaces o reorientarse dentro de una estructura. Los ligandos flexibles pueden doblarse, girar alrededor de los enlaces y reorientarse. Estas diferentes conformaciones crean más variedad en la estructura. Hay ejemplos de polímeros de coordinación que incluyen dos configuraciones del mismo ligando dentro de una estructura,[13] así como dos estructuras separadas donde la única diferencia entre ellas es la orientación del ligando.
Longitud del ligando[editar]
La longitud del ligando puede ser un factor importante para determinar la posibilidad de formación de una estructura polimérica frente a estructuras no poliméricas (mono u oligoméricas).[14]
Otros factores[editar]
Contraión[editar]
Además de la elección del metal y del ligando, hay muchos otros factores que afectan a la estructura del polímero de coordinación. Por ejemplo, la mayoría de los centros metálicos son iones con carga positiva que existen en forma de sales. El contraión de la sal puede afectar a la estructura global. Por ejemplo, las sales de plata como AgNO3, AgBF4, AgClO4, AgPF6, AgAsF6 y AgSbF6 se cristalizan todas con el mismo ligando, las estructuras varían en términos del entorno de coordinación del metal, así como la dimensionalidad de todo el polímero de coordinación.[15]
Entorno de cristalización[editar]
Además, las variaciones en el entorno de cristalización también pueden cambiar la estructura. Los cambios en el pH,[16] la exposición a la luz o los cambios en la temperatura[17] pueden cambiar la estructura resultante. Las influencias sobre la estructura basadas en cambios en el entorno de cristalización se determinan caso por caso.
Moléculas huésped[editar]

La estructura de los polímeros de coordinación suele incorporar espacio vacío en forma de poros o canales. Este espacio vacío es termodinámicamente desfavorable. Para estabilizar la estructura y evitar su colapso, los poros o canales suelen estar ocupados por moléculas huésped. Las moléculas huésped no forman enlaces con la red circundante, pero a veces interactúan a través de fuerzas intermoleculares, como los enlaces de hidrógeno o el apilamiento pi. En la mayoría de los casos, la molécula huésped es el disolvente en el que se cristalizó el polímero de coordinación, pero en realidad puede ser cualquier cosa (otras sales presentes, gases atmosféricos como oxígeno, nitrógeno, dióxido de carbono, etc.) La presencia de la molécula huésped a veces puede influir en la estructura al favorecer un poro o canal que de otro modo no existiría.
Aplicaciones[editar]
Los polímeros de coordinación se comercializan como colorantes. Particularmente útiles son los derivados de aminofenol. Los tintes complejos metálicos que usan cobre o cromo se usan comúnmente para producir colores opacos. Los colorantes de ligandos tridentados son útiles porque son más estables que sus equivalentes bidentados o monodentados.[18][19]
Uno de los primeros polímeros de coordinación comercializados son los compuestos de Hofmann, que tienen la fórmula Ni(CN)4 Ni(NH3)2. Estos materiales cristalizan con pequeños huéspedes aromáticos (benceno, ciertos xilenos), y esta selectividad ha sido explotada comercialmente para la separación de estos hidrocarburos.[20]
Tendencias de investigación[editar]
Almacenamiento molecular[editar]
Aunque todavía no son prácticos, los polímeros de coordinación porosos tienen potencial como tamices moleculares en paralelo con el carbón poroso y las zeolitas.[4] El tamaño y la forma del poro se pueden controlar mediante el tamaño del enlazador y la longitud y los grupos funcionales de los ligandos de conexión. Para modificar el tamaño de los poros con el fin de lograr una adsorción eficaz, se intercalan huéspedes no volátiles en el espacio del polímero de coordinación poroso para disminuir el tamaño de los poros. Los invitados de superficie activa también se pueden utilizar para contribuir a la adsorción. Por ejemplo, el MOF-177 de poro grande, 11,8 Å de diámetro, se puede dopar con moléculas C60 (6,83 Å de diámetro) o polímeros con un sistema altamente conjugado para aumentar el área de superficie para la adsorción de H2.
Los polímeros de coordinación flexibles y porosos son potencialmente atractivos para el almacenamiento molecular, ya que el tamaño de sus poros puede modificarse mediante cambios físicos. Un ejemplo de ello podría ser un polímero que contiene moléculas de gas en su estado normal, pero que al comprimirse se colapsa y libera las moléculas almacenadas. Dependiendo de la estructura del polímero, es posible que la estructura sea lo suficientemente flexible como para que el colapso de los poros sea reversible y el polímero pueda reutilizarse para absorber de nuevo las moléculas de gas.[21]
Luminiscencia[editar]
Los polímeros de coordinación luminiscentes suelen contener ligandos orgánicos cromóforos que absorben la luz y transmiten la energía de excitación al ion metálico. Los polímeros de coordinación son potencialmente las especies luminiscentes más versátiles debido a sus propiedades de emisión acopladas al intercambio de huéspedes. Las arquitecturas supramoleculares luminiscentes han despertado recientemente un gran interés debido a sus posibles aplicaciones en dispositivos optoelectrónicos o como sensores y sondas fluorescentes. Los polímeros de coordinación suelen ser más estables (resistentes al calor y a los disolventes) que las especies puramente orgánicas. En el caso de los ligandos que emiten fluorescencia sin la presencia del enlazador metálico (no debido a LMCT, banda de transferencia de carga), la emisión de fotoluminiscencia intensa de estos materiales tiende a ser magnitudes de orden superior a la del ligando libre solo. Estos materiales pueden utilizarse para diseñar posibles candidatos para dispositivos de diodos emisores de luz (LED). El espectacular aumento de la fluorescencia se debe al incremento de la rigidez y la asimetría del ligando cuando se coordina con el centro metálico.
Conductividad eléctrica[editar]
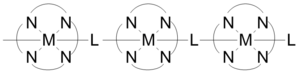
Los polímeros de coordinación pueden tener puentes cortos inorgánicos y orgánicos conjugados en sus estructuras, que proporcionan vías para la conducción eléctrica. Un ejemplo de este tipo de polímeros de coordinación son los marcos orgánicos metálicos conductores. Algunos polímeros de coordinación unidimensionales construidos como se muestra en la figura exhiben conductividades en un rango de 1x10-6 a 2x10-1 S/cm. La conductividad se debe a la interacción entre el orbital d del metal y el nivel pi* del ligando puente. En algunos casos, los polímeros de coordinación pueden tener un comportamiento semiconductor. Las estructuras tridimensionales formadas por láminas de polímeros que contienen plata demuestran semiconductividad cuando los centros metálicos están alineados, y la conducción disminuye a medida que los átomos de plata pasan de paralelos a perpendiculares.[22]
Magnetismo[editar]
Los polímeros de coordinación exhiben muchos tipos de magnetismo. El antiferromagnetismo, el ferrimagnetismo y el ferromagnetismo son fenómenos cooperativos de los espines magnéticos dentro de un sólido que surge del acoplamiento entre los espines de los centros paramagnéticos. Para permitir un magnetismo eficiente, los iones metálicos deben ser puenteados por ligandos pequeños que permitan contactos cortos metal-metal (como puentes oxo, ciano y azido).[22]
Capacidad del sensor[editar]
Los polímeros de coordinación también pueden mostrar cambios de color al cambiar las moléculas de disolvente incorporadas a la estructura. Un ejemplo de ello serían los dos polímeros de coordinación de Co del cluster [Re6S8(CN)6]4− que contiene ligandos de agua que se coordinan con los átomos de cobalto. Esta solución originalmente anaranjada se vuelve púrpura o verde al reemplazar el agua con tetrahidrofurano, y azul al agregar éter dietílico. Así, el polímero puede actuar como un sensor de disolventes que cambia físicamente de color en presencia de determinados disolventes. Los cambios de color se atribuyen a que el disolvente entrante desplaza los ligandos de agua de los átomos de cobalto, lo que provoca un cambio de su geometría de octaédrica a tetraédrica.[22]
Referencias[editar]
- ↑ a b Batten, Stuart R.; Champness, Neil R.; Chen, Xiao-Ming; Garcia-Martinez, Javier; Kitagawa, Susumu; Öhrström, Lars; O'Keeffe, Michael; Suh, Myunghyun P. et al. (2013). «Terminology of metal–organic frameworks and coordination polymers (IUPAC Recommendations 2013)». Pure and Applied Chemistry 85 (8): 1715. doi:10.1351/PAC-REC-12-11-20.
- ↑ a b Fromm, K. (2008). «Coordination polymer networks with s-block metal ions». Coord. Chem. Rev. 252 (8–9): 856-885. doi:10.1016/j.ccr.2007.10.032.
- ↑ Chen, X; Ye, B.; Tong, M. (2005). «Metal-organic molecular architectures with 2,2′-bipyridyl-like and carboxylate ligands». Coord. Chem. Rev. 249 (5–6): 545-565. doi:10.1016/j.ccr.2004.07.006.
- ↑ a b Kitagawa, S.; Kitaura, R.; Noro, S. I. (2004). «Functional Porous Coordination Polymers». Angewandte Chemie International Edition 43 (18): 2334-2375. PMID 15114565. doi:10.1002/anie.200300610.
- ↑ Lamming, Glenn; El-Zubir, Osama; Kolokotroni, James; McGurk, Christopher; Waddell, Paul G.; Probert, Michael R.; Houlton, Andrew (3 de octubre de 2016). «Two-Dimensional Frameworks Based on Ag(I)–N Bond Formation: Single Crystal to Single Molecular Sheet Transformation». Inorganic Chemistry 55 (19): 9644-9652. ISSN 0020-1669. PMID 27631950. doi:10.1021/acs.inorgchem.6b01365.
- ↑ Charpin, P.; Nierlich, M.; Vigner, D.; Lance, M.; Baudry, D. (1987). «Structure of the Second Crystalline Form of Uranium(IV) Tetrahydroborate». Acta Crystallographica Section C 43 (8): 1465-p1467. doi:10.1107/S0108270187091431.
- ↑ Robin, A. Y.; Fromm, K. M. (2006). «Coordination polymer networks with O- and N-donors: What they are, why and how they are made». Coord. Chem. Rev. 250 (15–16): 2127-2157. doi:10.1016/j.ccr.2006.02.013.
- ↑ Cote, A; Shimizu, G. (2003). «Coordination Solids via Assembly of Adaptable Components : Systematic Structural Variation in Alkaline Earth Organosulfonate Networks». Chem. Eur. J. 9 (21): 5361-5370. PMID 14613146. doi:10.1002/chem.200305102.
- ↑ Bernstein, Jeremy; Paul M. Fishbane; Stephen G. Gasiorowicz (3 de abril de 2000). Modern Physics. Prentice-Hall. p. 624. ISBN 978-0-13-955311-0.
- ↑ Wen, M.; Munakata, M.; Suenaga, Y.; Kuroda-Sowa, T.; Maekawa, M.; Yan, S. G. (2001). «Silver(I) coordination polymers of cyclic sulfur ligand, 2,2′,3,3′-tetrahydro-4,4′-dithia-1,1′-binaphthylidene». Inorganica Chimica Acta 322 (1–2): 133-137. doi:10.1016/S0020-1693(01)00556-4.
- ↑ Hung-Low, F.; Klausmeyer, K. K.; Gary, J. B. (2009). «Effect of anion and ligand ratio in self-assembled silver(I) complexes of 4-(diphenylphosphinomethyl)pyridine and their derivatives with bipyridine ligands». Inorganica Chimica Acta 362 (2): 426. doi:10.1016/j.ica.2008.04.032.
- ↑ Ricci, G.; Sommazzi, A.; Masi, F.; Ricci, M.; Boglia, A.; Leone, G. (2010). «Well-defined transition metal complexes with phosphorus and nitrogen ligands for 1,3-dienes polymerization». Coordination Chemistry Reviews 254 (5–6): 661. doi:10.1016/j.ccr.2009.09.023.
- ↑ Knaust, J. M.; Keller, S. W. (2002). «A Mixed-Ligand Coordination Polymer from the in Situ, Cu(I)-Mediated Isomerization of Bis(4-pyridyl)ethylene». Inorganic Chemistry 41 (22): 5650-2. PMID 12401066. doi:10.1021/ic025836c.
- ↑ Buvailo, Andrii I.; Gumienna-Kontecka, Elzbieta; Pavlova, Svetlana V.; Fritsky, Igor O.; Haukka, Matti (2010). «Dimeric versus polymeric coordination in copper(ii) cationic complexes with bis(chelating) oxime and amide ligands». Dalton Transactions 39 (27): 6266-75. PMID 20520918. doi:10.1039/C0DT00008F.
- ↑ Carlucci, L.; Ciani, G.; Proserpio, D. M.; Rizzato, S. (2002). «New polymeric networks from the self-assembly of silver(i) salts and the flexible ligand 1,3-bis(4-pyridyl)propane (bpp). A systematic investigation of the effects of the counterions and a survey of the coordination polymers based on bpp». CrystEngComm 4 (22): 121. doi:10.1039/b201288j.
- ↑ Ni, L. B.; Zhang, R. H.; Liu, Q. X.; Xia, W. S.; Wang, H.; Zhou, Z. H. (2009). «PH- and mol-ratio dependent formation of zinc(II) coordination polymers with iminodiacetic acid: Synthesis, spectroscopic, crystal structure and thermal studies». Journal of Solid State Chemistry 182 (10): 2698-2706. Bibcode:2009JSSCh.182.2698N. PMC 2778864. PMID 20161370. doi:10.1016/j.jssc.2009.06.042.
- ↑ Tong, M. L.; Hu, S.; Wang, J.; Kitagawa, S.; Ng, S. W. (2005). «Supramolecular Isomerism in Cadmium Hydroxide Phases. Temperature-Dependent Synthesis and Structure of Photoluminescent Coordination Polymers of α- and β-Cd2(OH)2(2,4-pyda)». Crystal Growth & Design 5 (3): 837. doi:10.1021/cg049610r.
- ↑ Grychtol, K.; Mennicke, W. (2002) "Metal-Complex Dyes." In Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH. doi 10.1002/14356007.a16_299.
- ↑ Hunger, K.; Mischke, P.; Rieper, W.; Raue, R.; Kunde, K.; Engel, A. (2002) "Azo Dyes." In Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH. doi 10.1002/14356007.a03_245.
- ↑ Atwood, J. L. (2012) "Inclusion Compounds" in Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim. doi 10.1002/14356007.a14_119
- ↑ Bureekaew, S.; Shimomura, S.; Kitagawa, S. (2008). «Chemistry and application of flexible porous coordination polymers». Science and Technology of Advanced Materials 9 (1): 014108. Bibcode:2008STAdM...9a4108B. PMC 5099803. PMID 27877934. doi:10.1088/1468-6996/9/1/014108.
- ↑ a b c Batten, Stuart R. (2008). Coordination Polymers: Design, Analysis and Application. RSC Publishing. pp. 297-307, 396-407. ISBN 978-0-85404-837-3. doi:10.1039/9781847558862.
Enlaces externos[editar]
- Esta obra contiene una traducción derivada de «Coordination polymer» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.


