Pirrol
| Pirrol | |
|---|---|

| |
| Nomenclatura IUPAC | Pirrol Pirrol |
| Fórmula química | C4H5N |
| Masa molecular | 67.09 g/mol |
| Número CAS | [109-97-7] |
| Densidad | 0.967 g/cm³ |
| Punto de fusión | -23 °C |
| Punto de ebullición | 129-131 °C |
| SMILES | C1=CC=CN1 |
El pirrol es un compuesto químico orgánico heterocíclico aromático, un anillo de cinco miembros con la fórmula C4H5N.
Los pirroles son piezas para formar compuestos de anillos aromáticos más largos, incluyendo las porfirinas de hemo, las clorinas y bacterioclorinas, de clorofilas y el anillo de corrina.
Los pirroles tienen una basicidad muy baja comparada con la amina y otros compuestos aromáticos como la piridina donde el anillo del nitrógeno no se enlaza al átomo del hidrógeno. Esto es porque el par de electrones sin compartir del átomo del nitrógeno se convierte en el aromático.
El pirrol experimenta la sustitución electrofílica predominante en la 2.ª y 5.ª posición, aunque el producto de la substitución en las posiciones 3 y 4 se obtiene en producciones bajas.
En 1994 un reporte liberado por 5 importantes compañías de cigarrillo, el pirrol es uno de los 599 aditivos de los cigarrillos. Su uso o propósito, sin embargo, es desconocido.[1]
Propiedades
[editar]
El pirrol tiene una muy baja basicidad comparada a las aminas más comunes y a otros compuestos aromáticos como la piridina. Está disminuida basicidad relativa es causada por la deslocalización electrónica del par solitario del átomo de nitrógeno del anillo aromático. Luego el pirrol es una base muy débil con un pKa de alrededor de -4. La protonación del pirrol resulta en la pérdida de su aromaticidad y por lo tanto, la misma es termodinámicamente desfavorable.
Como muchas otras aminas, el pirrol se oscurece al estar expuesto al aire y la luz por lo que necesita ser destilado inmediatamente antes de usarlo.[2]
Síntesis
[editar]La preparación de sistemas heterocíclicos de cinco miembros con un nitrógeno como heteroátomo parte de diversas estrategias retrosintéticas:
- a) Por cierre de las posiciones 1,2
El pirrol es preparado a nivel industrial mediante el tratamiento del furano con amoníaco en presencia de un catalizador sólido ácido.[3] Se forma succinaldehído como intermediario y la ciclización se lleva a cabo por medio de una reacción tipo Paal-Knorr.
- la síntesis de Paal-Knorr se utiliza para sintetizar pirroles sustituidos:

Paal–Knorr Pyrrole Synthesis
- Varios sistemas derivados de saturación parcial o total del pirrol se pueden preparar por rutas similares:
Las maleimidas se pueden preparar por aminólisis del anhídrido maleico en donde se forma la semiamida maleica como intermediario:

De la misma forma, la succinimida se forma por calentamiento del succinato de amonio:[4]

La 2-pirrolidona se prepara por amonólisis de la butirolactona en donde se forma la 4-hidroxibutiramida como intermediario:

También se prepara 2-pirrolidona a partir de succinonitrilo , el cual se hidrogena parcialmente —usando níquel Raney como catalizador— a 3-aminopropionitrilo, para luego hidrolizarse con agua a presión y a 210 °C:[5][6]

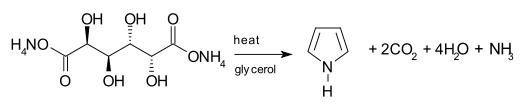
Otra vía sintética del pirrol involucra la descarboxilación del mucato de amonio, una sal de amonio del ácido múcico. Normalmente, la sal es calentada en un aparato de destilación con glicerol como solvente.[7]
- En la síntesis de pirroles de Hantzsch, se forma una base de Schiff entre el amoniaco y un α-cetoéster. La imina se encuentra en equilibrio con su enamina, la cual condensa con el carbonilo de una α-halocetona:
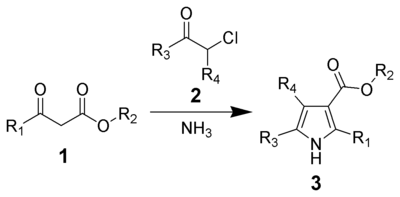
El nitrógeno de la imina-enamina reacciona con el carbono unido al halógeno en una reacción de SN2. De esta manera se forma un sistema 4-enaminocarbonílico (6). Este intermediario es el que da el cierre 1,2 del sistema pirrólico:

- Los reactivos iniciales en la síntesis de Piloty-Robinson son dos equivalentes de un aldehído y de hidrazina.[8][9] El producto es un pirrol con sustituyentes específicos en las posiciones 3 y 4. El aldehído reacciona con la diamina dando un intermediario di-imina (R–C=N−N=C–R), en el cual al agregar ácido clorhídrico resulta en el cierre del anillo y la pérdida de amoníaco dando el pirrol. En una alternativa a la misma, se trata primero al propionaldehído con hidrazina y luego con cloruro de benzoílo a altas temperaturas junto a una irradiación de microondas:[10]
En el segundo paso, tiene lugar una reacción sigmatrópica[3,3] entre los dos intermediarios de la reacción. El pirrol, finalmente, puede ser polimerizado para producir polipirrol.
b) Conexión en las posiciones 3-4
- la síntesis de Knorr

c) Conexión en las posiciones 2-3

d) Otras estrategias de conexión.
- Modificación de cicloadición de Diels Alder:

Reactividad
[editar]El protón NH en los pirroles es moderadamente ácido con un pKa de 16.5. El pirrol puede entonces ser desprotonado con bases fuertes como el butil-litio o el hidruro de sodio. El pirroluro resultante es nucleófilico. Luego al tratar esta base conjugada con un electrófilo como el ioduro de metilo nos da N-metilpirrol.
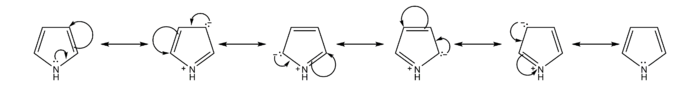
Las estructuras contribuyentes de resonancia del pirrol nos da un punto de vista más cercano a la reactividad del compuesto. Como el furano y el tiofeno, el pirrol es más reactivo que el benceno frente a la sustitución electrofilica aromática debido a que el mismo es capaz de estabilizar la carga positiva en el carbocatión intermedio.
Luego el pirrol experimenta la sustitución electrofílica aromática(SEAr) predominantemente en las posiciones 2 y 5. Dos reacciones especialmente notables destinadas a la producción de pirroles funcionalizados (con distintos grupos funcionales) son la Reacción de Mannich y la Reacción de Vilsmeier-Haack (abajo),[11][12] las cuales son compatibles con una gran variedad de sustratos pirrólicos.

Formilación de un derivado del pirrol (Garabatos-Perera 2007[11])
También el pirrol reacciona con aldehídos para dar porfirinas. Por ejemplo, el benzaldehído se condensa con el pirrol para dar tetrafenilporfirina. Además, los compuestos del pirrol pueden también participar en cicloadiciones como en la reacción de Diels-Alder bajo ciertas condiciones, por ejemplo, en presencia de catálisis ácida (de Lewis), calentamiento o alta presión.
El pirrol también polimeriza en la luz. Por lo que se puede usar un agente oxidante como el persulfato de amonio a 0 °C en la oscuridad, para controlar la polimerización.
Uso comercial
[editar]El pirrol no tiene una aplicación comercial significativa, pero el N-metilpirrol es un precursor del ácido N-metilpirrolcarboxílico, el cual se usa como precursor en la industria farmacéutica.[3]
Véase también
[editar] Wikcionario tiene definiciones y otra información sobre bacterioclorina.
Wikcionario tiene definiciones y otra información sobre bacterioclorina.- Polipirrol
- Indol, un derivado con un anillo fundido del benceno.
- Tiofeno, un análogo con un sulfuro en vez del átomo del nitrógeno.
- Furano, un análogo con un oxígeno en vez del nitrógeno.
- Fosfol, un análogo no aromático del fósforo.
- Arsol, un análogo arsénico moderado-aromático.
- Pirrolidina, el derivado hidrogenado saturado.
- Anillo aromático simple.
- Pirroluria.
Enlaces externos
[editar]- General Synthesis and Reactivity of Pyrrole
- Synthesis of pyrroles (overview of recent methods)
- Substitution reaction mechanisms of nitrogen-containing heteroaromatics
Referencias
[editar]- ↑ «Copia archivada». Archivado desde el original el 23 de mayo de 2006. Consultado el 4 de octubre de 2006.
- ↑ Armarego, Wilfred, L.F.; Chai, Christina, L.L. (2003). Purification of Laboratory Chemicals (5th edición). Elsevier. p. 346.
- ↑ a b Albrecht Ludwig Harreus "Pyrrole" in Ullmann's Encyclopedia of Industrial Chemistry, 2002, Wiley-VCH, Weinheim. doi 10.1002/14356007.a22_453
- ↑ Org. Synth. 1936, 16, 75 DOI: 10.15227/orgsyn.016.0075
- ↑ PROCESS FOR PRODUCING ALPHA-PYRROLIDONE. TAKAGI KAZUMI; MURAKAMI MASAHIRO; MATSUDA TERUO (1972). Patente US3644402 (A)
- ↑ Process for the preparation of a 2-pyrrolidone. DE MAN HENDRIKUS C J; CORVERS ANTONIUS; THOMISSEN PETRUS J H (1981). Patente EP0022292 (A1)
- ↑ Practical Organic Chemistry, Vogel, 1956, Page 837, Link (12 MB)
- ↑ Piloty, O. (1910). «Synthese von Pyrrolderivaten: Pyrrole aus Succinylobernsteinsäureester, Pyrrole aus Azinen». Chem. Ber. 43: 489. doi:10.1002/cber.19100430182.
- ↑ Robinson, Gertrude Maud; Robinson, Robert (1918). «LIV.—A new synthesis of tetraphenylpyrrole». J. Chem. Soc. 113: 639. doi:10.1039/CT9181300639.
- ↑ Benjamin C. Milgram, Katrine Eskildsen, Steven M. Richter, W. Robert Scheidt, and Karl A. Scheidt (2007). «Microwave-Assisted Piloty-Robinson Synthesis of 3,4-Disubstituted Pyrroles» (Note). J. Org. Chem. 72 (10): 3941-3944. PMC 1939979. PMID 17432915. doi:10.1021/jo070389.
- ↑ a b Jose R. Garabatos-Perera, Benjamin H. Rotstein, and Alison Thompson (2007). «Comparison of Benzene, Nitrobenzene, and Dinitrobenzene 2-Arylsulfenylpyrroles». J. Org. Chem. 72 (19): 7382-7385. PMID 17705533. doi:10.1021/jo070493r.
- ↑ The 2-sulfenyl group in the pyrrole substrate serves as an activating group and as a protective group that can be removed with Raney nickel