Pentaceno
| Pentaceno | ||
|---|---|---|
 | ||
| General | ||
| Fórmula estructural |
| |
| Fórmula molecular | C22H14 | |
| Identificadores | ||
| Número CAS | 135-48-8[1] | |
| ChEBI | 33148 | |
| ChemSpider | 8347 | |
| PubChem | 8671 | |
| UNII | 9FQU5HA0UY | |
| Propiedades físicas | ||
| Masa molar | 278,11 g/mol | |
El pentaceno (C22H14) es un hidrocarburo aromático policíclico formado por cinco anillos de benceno (C6H6) fusionados linealmente. Este compuesto altamente conjugado es un semiconductor orgánico. El compuesto genera excitones al absorber luz ultravioleta (UV) o visible, lo que lo hace muy sensible a la oxidación. Por esta razón, este compuesto, que es un polvo púrpura, se degrada lentamente al exponerse al aire y a la luz.
Estructuralmente, el pentaceno es uno de los acenos lineales, siendo el anterior el tetraceno (cuatro anillos de benceno fusionados) y el siguiente el hexaceno (seis anillos de benceno fusionados). En agosto de 2009, un grupo de investigadores de IBM publicó los resultados experimentales de la obtención de imágenes de una única molécula de pentaceno mediante un microscopio de fuerza atómica.[2][3] En julio de 2011, utilizaron una modificación de la microscopía de barrido en túnel para determinar experimentalmente las formas de los orbitales moleculares de mayor ocupación y menor desocupación. [4] [5]
En 2012, se demostró que el p -terfenilo dopado con pentaceno era eficaz como medio amplificador para un máser a temperatura ambiente.[6]
Síntesis[editar]


El pentaceno fue sintetizado por primera vez en 1912 por los químicos británicos William Hobson Mills y Mildred May Gostling. [8] [9] Un método clásico para la síntesis del pentaceno es mediante la reacción de Elbs. [10] [11]
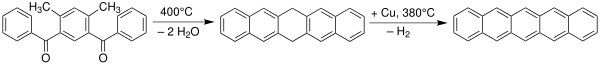
Investigación de materiales[editar]
Se han examinado los pentacenos como posibles colorantes dicroicos. La pentacenoquinona que se muestra a continuación es fluorescente y cuando se mezcla con la mezcla de cristal líquido E7 se alcanza una relación dicroica de 8.[12][13] Los acenos más largos se alinean mejor en la fase de cristal líquido nemático.
Combinado con buckminsterfullereno, el pentaceno se utiliza en el desarrollo de prototipos fotovoltaicos orgánicos. [14] [15] Las células fotovoltaicas orgánicas son más baratas y más flexibles que las células inorgánicas tradicionales, lo que potencialmente podría abrir puertas a las células solares en nuevos mercados. [16]
El pentaceno es una elección popular para la investigación sobre transistores orgánicos de película delgada y OFET, siendo una de las moléculas orgánicas conjugadas más investigadas con un alto potencial de aplicación debido a una movilidad de agujeros en OFETs de hasta 5,5 cm2/(V-s), que supera a la del silicio amorfo. [17] [18] [19]
El pentaceno, al igual que otros conductores orgánicos, se oxida rápidamente en el aire, lo que impide su comercialización. Si el pentaceno se oxida previamente, la pentaceno-quinona es un potencial aislante de puerta, y la movilidad puede aproximarse a la del rubreno -el semiconductor orgánico de mayor movilidad-, es decir, 40 cm2/(V-s). Esta técnica de oxidación del pentaceno es similar a la oxidación del silicio utilizada en la electrónica de silicio. [18]
Referencias[editar]
- ↑ Número CAS
- ↑ «Single molecule's stunning image». BBC News. 28 de agosto de 2009. Consultado el 28 de agosto de 2009.
- ↑ Gross, L.; Mohn, F; Moll, N; Liljeroth, P; Meyer, G (2009). «The Chemical Structure of a Molecule Resolved by Atomic Force Microscopy». Science 325 (5944): 1110-1114. Bibcode:2009Sci...325.1110G. PMID 19713523. S2CID 9346745. doi:10.1126/science.1176210.
- ↑ Krieger, K. (23 de agosto de 2011). «Molecules Imaged Most Intimately». Science Now. Consultado el 29 de junio de 2017.
- ↑ Gross, L.; Moll, N.; Mohn, F.; Curioni, A.; Meyer, G.; Hanke, F.; Persson, M. (2011). «High-Resolution Molecular Orbital Imaging Using a p-Wave STM Tip». Phys. Rev. Lett. 107 (8): 86101-86104. Bibcode:2011PhRvL.107h6101G. PMID 21929180. doi:10.1103/PhysRevLett.107.086101.
- ↑ Brumfiel, G. (2012). «Microwave laser fulfills 60 years of promise». Nature. doi:10.1038/nature.2012.11199.
- ↑ Dinca, L. E.; De Marchi, F.; MacLeod, J. M.; Lipton-Duffin, J.; Gatti, R.; Ma, D.; Perepichka, D. F.; Rosei, F. (2015). «Pentacene on Ni(111): Room-temperature molecular packing and temperature-activated conversion to graphene». Nanoscale 7 (7): 3263-3269. Bibcode:2015Nanos...7.3263D. PMID 25619890. doi:10.1039/C4NR07057G.
- ↑ Mills, William Hobson; Mills, Mildred (1912). «CCXXX.—The synthetical production of derivatives of dinaphthanthracene». J. Chem. Soc., Trans. 101: 2194-2208. doi:10.1039/CT9120102194.
- ↑ Chung, Hyunjoong; Diao, Ying (2016). «Polymorphism as an emerging design strategy for high performance organic electronics». J. Mater. Chem. C 4 (18): 3915-3933. doi:10.1039/C5TC04390E. «Since its synthesis in 1912 to the categorization of at least four different polymorphs in 2003, pentacene has developed into a benchmark organic semiconductor due to its excellent thin film transistor performance».
- ↑ Elbs, Karl (1886). «Beiträge zur Kenntniss aromatischer Ketone. Erste Mittheilung». J. Prakt. Chem. (en alemán) 33 (1): 180-188. doi:10.1002/prac.18860330119.
- ↑ Breitmaier, Eberhard; Jung, Günther (2005). «12.5.3 Elbs-Reaktion». Organische Chemie: Grundlagen, Stoffklassen, Reaktionen, Konzepte, Molekülstrukturen (en alemán) (5th edición). Stuttgart: Georg Thieme Verlag. p. 183. ISBN 9783135415055.
- ↑ Chen, Zhihua; Swager, TM (2007). «Synthesis and Characterization of Fluorescent Acenequinones as Dyes for Guest−Host Liquid Crystal Displays». Organic Letters 9 (6): 997-1000. PMID 17298074. doi:10.1021/ol062999m.
- ↑ En la síntesis de este compuesto, el material de partida se trata con 1,4-naftoquinona y DPT. El DTP convierte el oxo-norbornadieno en un furano intermedio. El segundo paso es la oxidación por PPTS
- ↑ Dissanayake, D. M. Nanditha M. (2007). «Nanoimprinted large area heterojunction pentacene-C[sub 60] photovoltaic device». Applied Physics Letters 90 (25): 253502. Bibcode:2007ApPhL..90y3502D. doi:10.1063/1.2749863.
- ↑ Efficiently Organic: Researchers Use Pentacene To Develop Next-generation Solar Power sciencedaily.com Link
- ↑ «Efficiently Organic: Researchers Use Pentacene To Develop Next-generation Solar Power». ScienceDaily (en inglés). Consultado el 14 de noviembre de 2017.
- ↑ Norbert Koch (2007). «Organic Electronic Devices and Their Functional Interfaces». ChemPhysChem 8 (10): 1438-55. PMID 17539032. doi:10.1002/cphc.200700177.
- ↑ a b Tatsuo Hasegawa; Jun Takeya (2009). «Organic field-effect transistors using single crystals». Sci. Technol. Adv. Mater. 10 (2): 024314. Bibcode:2009STAdM..10b4314H. PMC 5090444. PMID 27877287. doi:10.1088/1468-6996/10/2/024314.
- ↑ Yoshiro Yamashita (2009). «Organic semiconductors for organic field-effect transistors». Sci. Technol. Adv. Mater. 10 (2): 024313. Bibcode:2009STAdM..10b4313Y. PMC 5090443. PMID 27877286. doi:10.1088/1468-6996/10/2/024313.
Enlaces externos[editar]
- Datos sobre el pentaceno, consultado el 17 de abril de 2006.
- El transistor orgánico mejora con la edad, New Scientist, 2 de diciembre de 2007
- Pentacene Imaged, imágenes de IBM Pentaceno, la primera molécula fotografiada en detalle 29 de agosto de 2009
- Esta obra contiene una traducción derivada de «Pentacene» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.
