Herencia no mendeliana

La herencia no mendeliana es cualquier patrón de herencia genética en el que los caracteres no segregan de acuerdo con las leyes de Mendel. Estas leyes describen la herencia de caracteres ligados a genes individuales localizados en cromosomas en el núcleo celular. En la herencia mendeliana, cada padre contribuye con uno de los dos alelos posibles para un carácter. Si los genotipos de ambos padres en un cruzamiento genético se conocen, las leyes de Mendel pueden usarse para determinar la distribución de fenotipos esperados para la descendencia. Hay varias situaciones en las que las proporciones de fenotipos observados en la progenie no encajan con los valores esperados.
La herencia mendeliana juega un papel en varios procesos de enfermedad.[1]
Tipos
[editar]Dominancia incompleta
[editar]
En casos de herencia intermedia debido a dominancia incompleta, el principio de dominancia descubierto por Mendel no es aplicable. No obstante, el principio de uniformidad se cumple, dado que toda la descendencia en la generación F1 tiene el mismo genotipo y fenotipo. El principio de la segregación de genes de Mendel también se aplica, ya que en la generación F2 los individuos homocigóticos con los fenotipos de la generación paterna P aparecen. La herencia intermedia fue por primera vez examinada por Carl Correns en Mirabilis jalapa, especie que usó para sus experimentos genéticos.[2] Antirrhinum majus también muestra herencia intermedia en la pigmentación de la flor.[3][4]
Codominancia
[editar]
En casos de codominancia, los caracteres genéticos de ambos alelos diferentes del mismo gen-locus es claramente expresado en el fenotipo. Por ejemplo, en ciertas variedades de pollo, el alelo para plumas negras es codominante con el alelo para plumas blancas. Los pollos heterocigotos tienen un color conocido como "erminette", con manchas de plumas negras y blancas que aparecen por separado. Muchos genes humanos, incluyendo uno para una proteína que controla los niveles de colesterol en sangre, muestran también codominancia. Personas con la forma heterocigótica de este gen producen dos formas diferentes de la proteína, cada cual con un efecto diferente sobre los niveles de colesterol.[5]
Ligamiento genético
[editar]Cuándo los genes están localizados en el mismo cromosoma y no ha tenido lugar ningún sobrecruzamiento antes de la segregación de los cromosomas para formar los gametos, los rasgos genéticos serán heredados en conexión, debido al ligamiento genético. Estos casos constituyen una excepción a la ley mendeliana de segregación independiente (3ª ley de Mendel).[6]
Alelos múltiples
[editar]En herencia mendeliana, los genes tienen sólo dos alelos, como a y A. Mendel escogió conscientemente pares de caracteres genéticos, representados por dos alelos para sus experimentos de herencia. En la naturaleza, tales genes a menudo existen en más de dos formas diferentes, por lo que se dice que presentan múltiples alelos. Un individuo, por supuesto, presenta normalmente sólo dos copias de cada gen, pero dentro de una población se encuentran a menudo muchos alelos diferentes. El color de pelaje de un conejo está determinado por un solo gen del cual existen al menos cuatro alelos diferentes. Muestran un patrón de herencia codominante que puede producir cuatro colores de pelaje. En los genes para los colores de pelaje del perro allí son cuatro alelos en el locus Agouti. El alelo "aw" es dominante sobre los alelos "at" y "a" pero recesivo con respecto al alelo "Ay".
Muchos otros genes tienen alelos múltiples, incluyendo los genes humanos para grupo sanguíneo ABO.
Epistasia
[editar]Si uno o más genes no pueden ser expresados debido a otro factor genético que obstaculiza su expresión, pudiendo esta epistasia hacerlo imposible incluso para alelos dominantes en ciertosproduciendo un efecto en el fenotipo. Un ejemplo en genética del pelaje del perro es la homocigosis con el alelo "e e" en el locus Extensión haciendo imposible la producción de cualquiera otro pigmento que la pheomelanina. A pesar de que el alelo "e" es un alelo recesivo en el locus extensión, la presencia de dos copias influye en la dominancia de otros genes de color del pelaje. Los gatos domésticos tienen un gen con un efecto similar en el cromosoma X.[7]
Herencia ligada al sexo
[editar]Los rasgos genéticos localizados en gonosomas a veces muestran patrones de herencia no mendeliana. Los individuos pueden desarrollar un carácter recesivo en el fenotipo dependiendo de su sexo—por ejemplo, ceguera de color y hemofilia (ver sistema de determinación del sexo).[8][9] Dado que muchos de los alelos son dominantes o recesivos, una correcta comprensión de los principios de la herencia mendeliana es un requisito importante para entender los patrones de herencia más complejos de la herencia ligada al sexo.[10] Vinculado al sexo describe los patrones de lectura de herencia y presentación específicos del sexo cuando una mutación genética está presente en un cromosoma sexual en lugar de un cromosoma no sexual. En humanos, estos se denominan recesivos ligados a X, dominantes ligados a X y ligados a Y.
Herencia Extranuclear
[editar]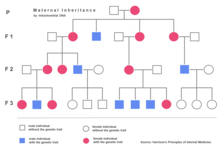
La herencia extranuclear (también conocida como herencia citoplasmática) es una forma de herencia no mendeliana descubierta también por Carl Correns en 1908.[11] Mientras trabajaba con Mirabilis jalapa, Correns observó que el color de la hoja era dependiente sólo del genotipo del progenitor materno. Basado en estos datos, determinó que el rasgo se transmitía a través de un carácter presente en el citoplasma del óvulo. Investigaciones posteriores realizadas por Ruth Sager y otros identificaron al ADN presente en cloroplastos como responsable del patrón de herencia inusual observado. Trabajos con cepas del moho Neurospora crassa iniciados por Mary y Hershel Mitchell[12] finalmente llevaron al descubrimiento de material genético en las mitocondrias, el ADN mitocondrial.
Según la teoría de la simbiogénesis, mitocondrias y cloroplastos serían endosimbiontes procedentes de organismos de vida libre que fueron incorporados para formar la actual célula eucariota.[13] Con el tiempo, mitocondrias y cloroplastos establecieron una relación simbiótica con sus anfitriones eucariotas. A pesar de que la transferencia de un número de genes de estos orgánulos al núcleo les impide una vida independiente, ambos todavía poseen material genético en la forma de doble hélice de ADN.[14]
La herencia extranuclear es el resultado de la transmisión del ADN de estos orgánulos. Tanto cloroplastos como mitocondrias están presentes únicamente en el citoplasma de los gametos maternos. Los gametos paternos (por ejemplo, esperma) no poseen mitocondrias en su citoplasma. Por ello, el fenotipo de los caracteres ligados a genes de mitocondrias y cloroplastos está determinado exclusivamente por el progenitor materno.
En humanos, las enfermedades mitocondriales son un tipo de enfermedades, muchas de las cuales afectan a músculos y ojo.
Rasgos poligénicos
[editar]Muchos rasgos están determinados por la interacción de varios genes. Los caracteres controlados por dos o más genes se denominan poligénicos. Poligénico significa que "muchos genes" son necesarios para que el organismo desarrolle el carácter. Por ejemplo, al menos tres genes están implicados en la determinación el pigmento marrón rojizo en los ojos de moscas de la fruta. Los caracteres poligénicos a menudo muestran una amplia gama fenotipos. La extensa variedad del color de piel en humanos proviene en parte de que al menos cuatro genes diferentes probablemente controlan este carácter.[15]
Conversión génica
[editar]La conversión génica puede ser una de las principales formas de herencia no mendeliana. La conversión génica aparece durante la reparación del ADN por recombinación, por la cual un fragmento de la secuencia informativa del ADN es transferida desde una hélice de ADN (que permanece sin cambios) a otra hélice de ADN, cuya secuencia es alterada. Esto puede ocurrir como una reparación de discordancias entre las cadenas de ADN que provienen de diferentes progenitores. De este modo la reparación de discordancias puede convertir un alelo en el otro. Este fenómeno se puede detectar a través de las proporciones no mendelianas de la progenie, y es a menudo observada, por ejemplo, en cruzamientos en hongos.
Herencia infecciosa
[editar]Otro tipo de herencia no mendeliana es el conocido como herencia infecciosa. Las partículas infecciósas como los virus pueden infectar a células hospedadoras y permanecer en el citoplasma de dichas células. Si la presencia de estas partículas da como resultado un fenotipo alterado, entonces este fenotipo puede ser posteriormente transmitido a la progenie .[16] Dado que este fenotipo es dependiente únicamente de la presencia del invasor en el citoplasma de las células hospedadoras, la herencia estará determinada solo por el estatus infeccioso del progenitor materno. Esto dará como resultado una transmisión uniparental del carácter, tal y como sucede en la herencia extranuclear.
Uno de los ejemplos mejor estudiados de herencia contagiosa es el fenómeno letal exhibido en levaduras. Dos virus de ARN de doble cadena, designados como L y M, son los responsables de este fenotipo.[17] El virus L codifica las proteínas de cápside de ambos virus, así como una ARN polimerasa. Así, el virus M sólo puede infectar células que ya albergan partículas del virus L. El ARN viral M codifica una toxina que es secretada por la célula anfitriona. Esto mata a las células susceptibles que crecen en la cercanía de las células hospedadoras. El ARN M viral también vuelve a la célula anfitriona inmune a los efectos letales de la toxina. Para que una célula sea susceptible, lo por tanto, tiene que ser o no infectada o albergar sólo el virus L.
Los virus L y M no son capaces de salir de su célula anfitriona por medios convencionales. Sólo pueden transferirse de célula a célula cuando su anfitrión se acopla. Toda progenie de un apareamiento que implica a una célula de levadura doblemente infectada también será infectada con los virus L y M. Por tanto, el fenotipo letal será transmitido a toda la progenie.
Caracteres heredables que resultan de la infección con partículas extrañas también han sido identificados en Drosophila. Las moscas de tipo salvaje normalmente se recuperan completamente después de ser anestesiadas con dióxido de carbono. Se han identificado ciertas líneas de moscas que mueren después de la exposición al compuesto. Esta sensibilidad al dióxido de carbono es transmitida de las madres a su progenie. Esta sensibilidad se debe a la infección con virus σ (Sigma), un rhabdovirus capaz solamente de infectar a Drosophila.[18]
Aunque este proceso suele estar asociado con virus, investigaciones recientes han demostrado que la bacteria Wolbachia también es capaz de insertar su genoma en el de su huésped.[19][20]
Impronta genética
[editar]La impronta genética representa otro ejemplo más de herencia no mendeliana. Al igual que en la herencia convencional, los genes de un rasgo dado son transmitidos a la progenie por ambos padres. Sin embargo, estos genes se marcan epigenéticamente antes de la transmisión, alterando sus niveles de expresión. Estas huellas se crean antes de la formación de los gametos y se borran durante la creación de células de la línea germinal. Por lo tanto, se puede hacer un nuevo patrón de impresión con cada generación.
Los genes se imprimen de manera diferente según el origen parental o maternal del cromosoma que los contiene. En ratones, el gen del factor de crecimiento insulínico tipo 2 experimenta impronta. La proteína codificada por este gen ayuda a regular el tamaño corporal. Los ratones que poseen dos copias funcionales de este gen son más grandes que los que tienen dos copias mutantes.El tamaño de los ratones que son heterocigotos en este locus depende del progenitor del que procede el alelo de tipo salvaje. Si el alelo funcional proviene de la madre, la descendencia exhibirá enanismo, mientras que un alelo paterno generará un ratón de tamaño normal. Esto se debe a que el gen Igf2 materno está impreso. La impresión da como resultado la inactivación del gen Igf2 en el cromosoma transmitido por la madre.[21]
Las impresiones se forman debido a la metilación diferencial de los alelos maternos y paternos. Esto da como resultado una expresión diferente entre los alelos de los dos padres. Los sitios con metilación significativa están asociados con bajos niveles de expresión génica. La expresión génica más alta se produce en sitios no metilados.[22] En este modo de herencia, el fenotipo está determinado no solo por el alelo específico transmitido a la descendencia, sino también por el sexo del padre que lo transmitió.
Mosaicismo
[editar]Los individuos que poseen células con diferencias genéticas con respecto a otras células y en diferentes periodos del desarrollo. Si una mutación tiene lugar en los tejidos no formadores de gametos, se la conoce como somática. Las mutaciones germinales ocurren en el huevo o células espermáticas y pueden ser transmitidas a la descendencia.[23] Las mutaciones que se producen al principio del desarrollo afectarán a un mayor número de células y pueden dar lugar a un individuo que puede ser identificado como un mosaico basándose estrictamente en el fenotipo.
El mosaicismo también es consecuencia de un fenómeno conocido como inactivación X. Todas las hembras de mamíferos tienen dos cromosomas X. Para impedir problemas de letalidad asociados, uno de estos cromosomas es inactivado después de la fertilización. Este proceso ocurre aleatoriamente en todas las células del organismo. Dado que los dos cromosomas X de una mujer dada casi siempre difieren en su patrón concreto de alelos, esto resultará en diferentes fenotipos en cada célula según qué cromosoma sea el silenciado. Los gatos Calico, los cuales son casi todos hembras,[24] muestran una de las manifestaciones más generalmente observadas de este proceso.[25]
Trastornos por repetición de trinucleótidos
[editar]Los trastornos por repetición de trinucleótidos tampoco siguen un patrón de herencia mendeliana. Estas enfermedades son causadas por la expansión de repeticiones en tándem de microsatélites, que consisten en tramos de tres nucleótidos.[26] En individuos normales, el número de unidades repetidas es relativamente bajo. En generaciones sucesivas, hay posibilidad de que el número de repeticiones se amplíe. A medida que esto ocurre, la progenie puede progresar al estatus afectado. Los individuos con un número de repeticiones grande (denominadas premutaciones) tienen una probabilidad alta de tener hijos afectados. Los que progresan a un estado afectado muestran síntomas de la enfermedad. Entre los trastornos por repetición de trinucleótidos más destacables se encuentran el síndrome del X frágil y la enfermedad de Huntington. En el caso del síndrome del X frágil se cree que los síntomas son resultado del incremento de metilaciones y la consecuente reducción en la expresión del gen de retraso mental en individuos con un suficiente número de repeticiones.[27]
Véase también
[editar]Referencias
[editar]- ↑ «Mechanisms of non-Mendelian inheritance in genetic disease». Hum. Mol. Genet. 13 Spec No 2: R225-33. 2004. PMID 15358729. doi:10.1093/hmg/ddh254.
- ↑ Biology University of Hamburg: Mendelian Genetics
- ↑ Levine, Louis (1979). «3». Biología del gen. Barcelona: Ediciones Omega S.A. pp. 66-68. ISBN 84-282-0551-5.
- ↑ Neil A. Campbell, Jane B. Reece: Biologie. Spektrum-Verlag Heidelberg-Berlin 2003, ISBN 3-8274-1352-4, page 302.
- ↑ Levine, Louis (1979). «3». Biología del gen. Barcelona: Ediciones Omega S.A. p. 68. ISBN 84-282-0551-5.
- ↑ Levine, Louis (1979). «7». Biología del gen. Barcelona: Ediciones Omega S.A. p. 136-169. ISBN 84-282-0551-5.
- ↑ Levine, Louis (1979). «3». Biología del gen. Barcelona: Ediciones Omega S.A. p. 68-77. ISBN 84-282-0551-5.
- ↑ Joseph Schacherer: Beyond the simplicity of Mendelian inheritance Science Direct 2016
- ↑ Khan Academy: Variations on Mendel's laws (overview)
- ↑ Levine, Louis (1979). «4». Biología del gen. Barcelona: Ediciones Omega S.A. p. 97-115. ISBN 84-282-0551-5.
- ↑ Klug, William S.; Michael R. Cummings; Charlotte A. Spencer (2006). Concepts of Genetics. Upper Saddle River, NJ: Pearson Education Inc. p. 215.
- ↑ «A case of "maternal" inheritance in Neurospora crassa». Proc. Natl. Acad. Sci. U.S.A. 38 (5): 442-9. 1952. PMC 1063583. PMID 16589122. doi:10.1073/pnas.38.5.442.
- ↑ Embley, T. Martin; William Martin (March 2006). «Eukaryotic evolution, changes and challenges». Nature 440 (7084): 623-630. PMID 16572163. doi:10.1038/nature04546.
- ↑ Levine, Louis (1979). «8». Biología del gen. Barcelona: Ediciones Omega S.A. p. 170-192. ISBN 84-282-0551-5.
- ↑ Levine, Louis (1979). «4». Biología del gen. Barcelona: Ediciones Omega S.A. p. 82-96. ISBN 84-282-0551-5.
- ↑ Klug, William S.; Michael R. Cummings; Charlotte A. Spencer (2006). Concepts of Genetics. Upper Saddle River, NJ: Pearson Education Inc. p. 223.
- ↑ Russell, Peter J. (2006). iGenetics: A Mendelian Approach. San Francisco: Pearson Education, Inc. pp. 649–650.
- ↑ Teninges, Danielle; Francoise Bras-Herreng (July 1987). «Rhabdovirus Sigma, the Hereditary CO2 Sensitivity Agent of Drosophila:Nucleotide Sequence of a cDNA Clone Encoding the Glycoprotein». Journal of General Virology 68 (10): 2625-2638. PMID 2822842. doi:10.1099/0022-1317-68-10-2625.
- ↑ «University of Rochester Press Releases». Consultado el 16 de octubre de 2007.
- ↑ «Widespread lateral gene transfer from intracellular bacteria to multicellular eukaryotes». Science 317 (5845): 1753-6. 2007. PMID 17761848. doi:10.1126/science.1142490.
- ↑ Bell, A.C.; G. Felsenfeld (2000). «Methylation of a CTCF-dependent boundar control imprinted expression of the Igf2 gene». Nature 405 (6785): 482-485. PMID 10839546. doi:10.1038/35013100.
- ↑ Lewin, Benjamin (2004). Genes VIII. Upper Saddle River, NJ: Pearson Education Inc. pp. 680–684.
- ↑ «Lesson 3: Mosaicism». Archivado desde el original el 8 de agosto de 2009. Consultado el 16 de octubre de 2007.
- ↑ «Genetics of Calico Color».
- ↑ «Genetic Mosaicism». Consultado el 28 de octubre de 2007.
- ↑ «Lesson 1: Triplet Repeat Expansion». Consultado el 16 de octubre de 2007.
- ↑ «FMR1-Related Disorders». Archivado desde el original el 21 de diciembre de 2007. Consultado el 29 de octubre de 2007.
Enlaces externos
[editar]- Herencia no mendeliana Archivado el 21 de diciembre de 2007 en Wayback Machine. en Universidad de Duque
