Átomo

El átomo es la unidad fundamental de los elementos químicos. Los átomos son microscópicos; los tamaños típicos son alrededor de 100 pm (diez mil millonésima parte de un metro).[1] No obstante, los átomos no tienen límites bien definidos y hay diferentes formas de definir su tamaño que dan valores diferentes pero cercanos. Los átomos son lo suficientemente pequeños para que la física clásica dé resultados notablemente incorrectos. A través del desarrollo de la física, los modelos atómicos han incorporado principios cuánticos para explicar y predecir mejor su comportamiento.
El término proviene del latín atŏmus, calco del griego ἄτομον (átomon) ἄτομος, unión de α (a, que significa «sin»), y τόμος (tómos, «sección»), que literalmente es «que no se puede cortar, indivisible»,[2] y fue el nombre que le dio Demócrito de Abdera, así como su maestro Leucipo de Mileto, a los elementos que constituirían los principios (solo accesibles mediante la razón) indivisibles del cosmos a partir de los cuales, y mediante el torbellino provocado por sus choques en el vacío a causa de las diferencias de peso entre ellos, se generaría la totalidad del mundus adspectabilis o fenomenológico.[3]
Cada átomo se compone de un núcleo y una región a su alrededor conocida como nube de electrones. El núcleo está compuesto de dos tipos de partículas subatómicas: protones, que tienen una carga eléctrica positiva, y neutrones, que no tienen carga eléctrica.[4] Puede existir uno o más protones y típicamente un número similar de neutrones.[5] Los protones y los neutrones son llamados nucleones, por formar parte del núcleo. Más del 99,94 % de la masa del átomo está en el núcleo.
Fuera del núcleo, en la región conocida como nube de electrones, se sitúan otro tipo de partículas subatómicas, los electrones, que tienen una carga eléctrica negativa. Si el número de protones y electrones son iguales, ese átomo es eléctricamente neutro. Si un átomo tiene más o menos electrones que protones, entonces tiene una carga global negativa o positiva, respectivamente, y se denomina ion (anión si es negativa y catión si es positiva). Cada sólido, líquido, gas y plasma se compone de átomos neutros o ionizados.
Los electrones de la nube son atraídos por los protones del núcleo por la fuerza electromagnética. Los protones y los neutrones en el núcleo son atraídos el uno al otro por una fuerza diferente, la fuerza nuclear, que es generalmente más fuerte que la fuerza electromagnética que repele los protones cargados positivamente entre sí. Bajo ciertas circunstancias, más acentuado cuanto mayor número de protones tenga el átomo, la fuerza electromagnética repelente se vuelve más fuerte que la fuerza nuclear y los nucleones pueden ser expulsados o desechados del núcleo, dejando tras de sí un elemento diferente: desintegración nuclear que resulta en transmutación nuclear.
El número de protones en el núcleo define a qué elemento químico pertenece el átomo:[6] por ejemplo, todos los átomos de cobre contienen 29 protones. El número de neutrones, también en el núcleo, define el isótopo del elemento.[7] El número de electrones, fuera del núcleo, influye en las propiedades magnéticas del átomo. Los átomos pueden unirse a otro u otros átomos por enlaces químicos (en los cuales intervienen los electrones de dichos átomos) para formar compuestos químicos tales como moléculas y redes cristalinas. La capacidad de los átomos de asociarse y disociarse es responsable de la mayor parte de los cambios físicos observados en la naturaleza y es el tema de la disciplina de la química.
Existe la antimateria, la cual está compuesta también por átomos pero con las cargas invertidas;[8] los protones tienen carga negativa y se denominan antiprotones, y los electrones tienen una carga positiva y se denominan positrones. Es muchísimo menos frecuente en la naturaleza. Al entrar en contacto con la respectiva partícula (como los protones con los antiprotones y los electrones con los positrones) ambas se aniquilan generando un estallido de energía de rayos gamma y otras partículas.
No toda la materia del universo está compuesta de átomos; de hecho, solo el 5% o menos del universo está compuesto por estos. La materia oscura, que constituye según algunas estimaciones más del 20% del universo, no se compone de átomos, sino de partículas de un tipo actualmente desconocido. También cabe destacar la energía oscura, la cual es un componente que está distribuido por todo el universo, ocupando aproximadamente más del 70% de este.
Introducción
[editar]
El concepto de átomo como bloque básico e indivisible que compone la materia del universo fue postulado por la escuela atomista en la Antigua Grecia, en el siglo V a. C., siendo Demócrito (Abdera, Tracia, c. 460 a. C.-c. 370 a. C.) uno de sus exponentes.
Aristóteles, posteriormente, postula que la materia estaba formada por cuatro elementos, pero niega la idea de átomo. La teoría atomista fue sin embargo mantenida por diversas escuelas filosóficas, entre ellas la epicúrea. Para Epicuro los átomos son unidades indivisibles que poseen tres propiedades: forma, tamaño y peso. Se encuentran permanentemente en movimiento y se unen unos a otros en virtud de sus formas. Su número es infinito y la cantidad de sus formas también es muy grande (aunque no necesariamente infinita). Las propiedades de los cuerpos derivan de las propiedades atómicas.
Tras la Revolución científica, la escuela atomista griega fue reconsiderada por las nuevas generaciones de científicos de mediados del siglo XIX, cuando sus conceptos fueron introducidos para explicar las leyes químicas. Con el desarrollo de la física nuclear en el siglo XX se comprobó que el átomo puede subdividirse en partículas más pequeñas.[9][10]
Los átomos son objetos muy pequeños con masas igualmente minúsculas: su diámetro y masa son del orden de la diez mil millonésima parte de un metro y cuatrillonésima parte de un gramo. Solo pueden ser observados mediante instrumentos especiales tales como un microscopio de efecto túnel. Más de un 99,94 % de la masa del átomo está concentrada en su núcleo, en general repartida de manera aproximadamente equitativa entre protones y neutrones. El núcleo de un átomo puede ser inestable y sufrir una transmutación mediante desintegración radioactiva. Los electrones en la nube del átomo están repartidos en distintos niveles de energía u orbitales, y determinan las propiedades químicas del mismo. Las transiciones entre los distintos niveles dan lugar a la emisión o absorción de radiación electromagnética en forma de fotones, y son la base de la espectroscopia.
Estructura atómica
[editar]Partículas subatómicas
[editar]A pesar de que átomo significa ‘indivisible’, en realidad está formado por las denominadas partículas subatómicas, que se pueden clasificar en tres tipos, en función de su carga eléctrica: el átomo contiene 1) protones, con carga eléctrica positiva, 2) neutrones, sin carga eléctrica, y 3) electrones, con carga eléctrica negativa. (Existe la excepción del átomo de hidrógeno-1, que no contiene neutrones, y del catión hidrógeno o hidrón, que no contiene electrones.) Los protones y neutrones del átomo forman el núcleo atómico, y por ello se denominan nucleones. Los electrones están en movimiento permanente en una región que rodea al núcleo y que recibe el nombre de nube de electrones.
El electrón es la partícula más ligera de las que componen el átomo, con una masa de 9,11 · 10−31 kg. Tiene una carga eléctrica negativa, cuya magnitud se define como la carga eléctrica elemental, y se ignora si posee subestructura, por lo que se considera una partícula elemental. Los protones tienen una masa de 1,672 · 10−27 kg, 1836 veces la del electrón, y una carga positiva opuesta a la de este. Los neutrones tienen una masa de 1,69 · 10−27 kg, 1839 veces la del electrón, y no poseen carga eléctrica. Las masas de ambos nucleones son ligeramente inferiores dentro del núcleo, debido a la energía potencial del mismo, y sus tamaños son similares, con un radio del orden de 8 · 10−16 m o 0,8 femtómetros (fm).[11]
Ni el protón ni el neutrón son partículas elementales, sino que constituyen un estado ligado de quarks u y d, partículas fundamentales recogidas en el modelo estándar de la física de partículas, con cargas eléctricas iguales a +2/3 y −1/3 respectivamente, respecto de la carga elemental. Un protón contiene dos quarks u y un quark d, mientras que el neutrón contiene dos d y un u, en consonancia con la carga de ambos. Los quarks se mantienen unidos mediante la fuerza nuclear fuerte, mediada por gluones —del mismo modo que la fuerza electromagnética está mediada por fotones—. Además de estas, existen otras partículas subatómicas en el modelo estándar: más tipos de quarks, leptones cargados (similares al electrón), etc.
El núcleo atómico
[editar]Los protones y neutrones de un átomo se encuentran ligados en el núcleo atómico, en la parte central del mismo. El volumen del núcleo es aproximadamente proporcional al número total de nucleones, el número másico A,[12] lo cual es mucho menor que el tamaño del átomo, cuyo radio es del orden de 105 fm o 1 ángstrom (Å). Los nucleones se mantienen unidos mediante la fuerza nuclear, que es mucho más intensa que la fuerza electromagnética a distancias cortas, lo cual permite vencer la repulsión eléctrica entre los protones.[13]
Los átomos de un mismo elemento tienen el mismo número de protones, que se denomina número atómico y se representa por Z. Los átomos de un elemento dado pueden tener distinto número de neutrones: se dice entonces que son isótopos. Ambos números conjuntamente determinan el nucleido.
El núcleo atómico puede verse alterado por procesos muy energéticos en comparación con las reacciones químicas. Los núcleos inestables sufren desintegraciones que pueden cambiar su número de protones y neutrones emitiendo radiación. Un núcleo pesado puede fisionarse en otros más ligeros en una reacción nuclear o espontáneamente. Mediante una cantidad suficiente de energía, dos o más núcleos pueden fusionarse en otro más pesado.
En átomos con número atómico bajo, los núcleos con una cantidad distinta de protones y neutrones tienden a desintegrarse en núcleos con proporciones más parejas, más estables. Sin embargo, para valores mayores del número atómico, la repulsión mutua de los protones requiere una proporción mayor de neutrones para estabilizar el núcleo.[14]
La nube de electrones
[editar]
Los electrones en el átomo son atraídos por los protones a través de la atracción electromagnética. Esta fuerza los atrapa en un pozo de potencial electrostático alrededor del núcleo, lo que hace necesaria una fuente de energía externa para liberarlos. Cuanto más cerca está un electrón del núcleo, mayor es la fuerza atractiva, y mayor por tanto la energía necesaria para que escape.
Los electrones, como otras partículas, presentan simultáneamente propiedades de partícula puntual y de onda, y tienden a formar un cierto tipo de onda estacionaria alrededor del núcleo, en reposo respecto de este. Cada una de estas ondas está caracterizada por un orbital atómico, una función matemática que describe la probabilidad de encontrar al electrón en cada punto del espacio. El conjunto de estos orbitales es discreto, es decir, puede enumerarse, como es propio en todo sistema cuántico. La nube de electrones es la región ocupada por estas ondas, visualizada como una densidad de carga negativa alrededor del núcleo.
Cada orbital corresponde a un posible valor de energía para los electrones, que se reparten entre ellos. El principio de exclusión de Pauli prohíbe que más de dos electrones se encuentren en el mismo orbital. Pueden ocurrir transiciones entre los distintos niveles de energía: si un electrón absorbe un fotón con energía suficiente, puede saltar a un nivel superior; también desde un nivel más alto puede acabar en un nivel inferior, radiando el resto de la energía en un fotón. Las energías dadas por las diferencias entre los valores de estos niveles son las que se observan en las líneas espectrales del átomo.
Propiedades del átomo
[editar]Masa
[editar]La mayor parte de la masa del átomo viene de los nucleones, los protones y neutrones del núcleo. También contribuyen en una pequeña parte la masa de los electrones, y la energía de ligadura de los nucleones, en virtud de la equivalencia entre masa y energía. La unidad de masa que se utiliza habitualmente para expresarla es la unidad de masa atómica (u). Esta se define como la doceava parte de la masa de un átomo neutro de carbono-12 libre, cuyo núcleo contiene 6 protones y 6 neutrones, y equivale a 1,66 · 10−27 kg aproximadamente. En comparación el protón y el neutrón libres tienen una masa de 1,007 y 1,009 u. La masa de un átomo es entonces aproximadamente igual al número de nucleones en su núcleo —el número másico— multiplicado por la unidad de masa atómica. El átomo estable más pesado es el plomo-208, con una masa de 207,98 u.[15]
En química se utiliza también el mol como unidad de masa. Un mol de átomos de cualquier elemento equivale siempre al mismo número de estos (6,022 · 1023), lo cual implica que un mol de átomos de un elemento con masa atómica de 1 u pesa aproximadamente 1 gramo. En general, un mol de átomos de un cierto elemento pesa de forma aproximada tantos gramos como la masa atómica de dicho elemento.
Tamaño
[editar]Los átomos no están delimitados por una frontera clara, por lo que su tamaño se equipara con el de su nube electrónica. Sin embargo, tampoco puede establecerse una medida de esta, debido a las propiedades ondulatorias de los electrones. En la práctica se define el radio atómico estimándolo en función de algún fenómeno físico, como la cantidad y densidad de átomos en un volumen dado, o la distancia entre dos núcleos en una molécula.
Los diversos métodos existentes arrojan valores para el radio atómico de entre 0,5 y 5 Å. Dentro de la tabla periódica de los elementos, el tamaño de los átomos tiende a disminuir a lo largo de un periodo —una fila— para aumentar súbitamente al comienzo de uno nuevo, a medida que los electrones ocupan niveles de energía más altos.[16]
Las dimensiones del átomo son miles de veces más pequeñas que la longitud de onda de la luz (400-700 nm) por lo que estos no pueden ser observados utilizando instrumentos ópticos. En comparación, el grosor de un cabello humano es equivalente a un millón de átomos de carbono. Si una manzana fuera del tamaño de la Tierra, los átomos en ella serían tan grandes como la manzana original.[17]
Niveles de energía
[editar]Un electrón ligado en el átomo posee una energía potencial inversamente proporcional a su distancia al núcleo y de signo negativo, lo que quiere decir que esta aumenta con la distancia. La magnitud de esta energía es la cantidad necesaria para desligarlo, y la unidad usada habitualmente para expresarla es el electrónvoltio (eV). En el modelo mecanocuántico solo hay un conjunto discreto de estados o niveles en los que un electrón ligado puede encontrarse —es decir, enumerables—, cada uno con un cierto valor de la energía. El nivel con el valor más bajo se denomina el estado fundamental, mientras que el resto se denominan estados excitados.
Cuando un electrón efectúa una transición entre dos estados distintos, absorbe o emite un fotón, cuya energía es precisamente la diferencia entre los dos niveles. La energía de un fotón es proporcional a su frecuencia, así que cada transición se corresponde con una banda estrecha del espectro electromagnético denominada línea espectral.

Cada elemento químico posee un espectro de líneas característico. Estas se detectan como líneas de emisión en la radiación de los átomos del mismo. Por el contrario, si se hace pasar radiación con un espectro de frecuencias continuo a través de estos, los fotones con la energía adecuada son absorbidos. Cuando los electrones excitados decaen más tarde, emiten en direcciones aleatorias, por lo que las frecuencias características se observan como líneas de absorción oscuras. Las medidas espectroscópicas de la intensidad y anchura de estas líneas permite determinar la composición de una sustancia.
Algunas líneas espectrales se presentan muy juntas entre sí, tanto que llegaron a confundirse con una sola históricamente, hasta que fue descubierta su subestructura o estructura fina. La causa de este fenómeno se encuentra en las diversas correcciones a considerar en la interacción entre los electrones y el núcleo. Teniendo en cuenta tan solo la fuerza electrostática, ocurre que algunas de las configuraciones electrónicas pueden tener la misma energía aun siendo distintas. El resto de pequeños efectos y fuerzas en el sistema electrón-núcleo rompe esta redundancia o degeneración, dando lugar a la estructura final. Estos incluyen las correcciones relativistas al movimiento de electrón, la interacción de su momento magnético con el campo eléctrico y con el núcleo, etc.[18]
Además, en presencia de un campo externo los niveles de energía se ven modificados por la interacción del electrón con este, en general produciendo o aumentando la división entre los niveles de energía. Este fenómeno se conoce como efecto Stark en el caso de un campo eléctrico, y efecto Zeeman en el caso de un campo magnético.
Las transiciones de un electrón a un nivel superior ocurren en presencia de radiación electromagnética externa, que provoca la absorción del fotón necesario. Si la frecuencia de dicha radiación es muy alta, el fotón es muy energético y el electrón puede liberarse, en el llamado efecto fotoeléctrico.
Las transiciones a un nivel inferior pueden ocurrir de manera espontánea, emitiendo la energía mediante un fotón saliente; o de manera estimulada, de nuevo en presencia de radiación. En este caso, un fotón «entrante» apropiado provoca que el electrón decaiga a un nivel con una diferencia de energía igual a la del fotón entrante. De este modo, se emite un fotón saliente cuya onda asociada está sincronizada con la del primero, y en la misma dirección. Este fenómeno es la base del láser.
Interacciones eléctricas entre protones y electrones
[editar]Antes del experimento de Rutherford la comunidad científica aceptaba el modelo atómico de Thomson, situación que varió después de la experiencia de Ernest Rutherford. Los modelos posteriores se basan en una estructura de los átomos con una masa central cargada positivamente rodeada de una nube de carga negativa.[19]
Este tipo de estructura del átomo llevó a Rutherford a proponer su modelo en que los electrones se moverían alrededor del núcleo en órbitas. Este modelo tiene una dificultad proveniente del hecho de que una partícula cargada acelerada, como sería necesario para mantenerse en órbita, radiaría radiación electromagnética, perdiendo energía. Las leyes de Newton, junto con las ecuaciones de Maxwell del electromagnetismo aplicadas al átomo de Rutherford llevan a que en un tiempo del orden de 10−10 s, toda la energía del átomo se habría radiado, con la consiguiente caída de los electrones sobre el núcleo.[20]
Historia de la teoría atómica
[editar]
El concepto de átomo existe desde la antigua Grecia, propuesto por los filósofos griegos Demócrito, Leucipo y Epicuro, sin embargo, no se generó el concepto por medio de la experimentación sino como una necesidad filosófica que explicara la realidad, ya que, como proponían estos pensadores, «la materia no puede dividirse indefinidamente, por lo que debe existir una unidad o bloque indivisible e indestructible que al combinarse de diferentes formas, creara todos los cuerpos macroscópicos que nos rodean»,[21] conceptos muy vigentes, ya que la propiedad de indestructibilidad e indivisibilidad fueron el «pilar fundamental de la química y física moderna».
El siguiente avance significativo no se realizó hasta que en 1773 el químico francés Antoine-Laurent de Lavoisier postuló su enunciado: «La materia no se crea ni se destruye, simplemente se transforma». La ley de conservación de la masa o ley de conservación de la materia; demostrada más tarde por los experimentos del químico inglés John Dalton quien en 1804, luego de medir la masa de los reactivos y productos de una reacción, concluyó que las sustancias están compuestas de átomos esféricos idénticos para cada elemento, pero diferentes de un elemento a otro.[22]
Luego, en 1811, el físico italiano Amedeo Avogadro postuló que a una temperatura, presión y volumen dados, un gas contiene siempre el mismo número de partículas, sean átomos o moléculas, independientemente de la naturaleza del gas, proponiendo al mismo tiempo la hipótesis de que los gases son moléculas poliatómicas, con lo que se comenzó a distinguir entre átomos y moléculas.[23]
El químico ruso Dmítri Ivánovich Mendeléyev creó en 1869 una clasificación de los elementos químicos en orden creciente de su masa atómica, remarcando que existía una periodicidad en las propiedades químicas. Este trabajo fue el precursor de la tabla periódica de los elementos como la conocemos actualmente.[24]
La visión moderna de su estructura interna tuvo que esperar hasta el experimento de Rutherford en 1911. Este experimento llevó al modelo atómico de Rutherford que no podía explicar adecuadamente la estabilidad de los átomos ni los espectros atómicos, por lo que Niels Bohr formuló su modelo atómico de Bohr en términos heurísticos, que daba cuenta de esos hechos sin explicarlos convenientemente. Posteriores descubrimientos científicos, como la teoría cuántica, y avances tecnológicos, como el microscopio electrónico, han permitido conocer con mayor detalle las propiedades físicas y químicas de los átomos.[25]
Evolución del modelo atómico
[editar]


La concepción del átomo que se ha tenido a lo largo de la historia ha variado de acuerdo a los descubrimientos realizados en el campo de la física y la química. A continuación se hará una exposición de los modelos atómicos propuestos por los científicos de diferentes épocas. Algunos de ellos son completamente obsoletos para explicar los fenómenos observados actualmente, pero se incluyen a manera de reseña histórica.
Modelo de Dalton
[editar]Fue el primer modelo atómico con bases científicas comprobables, fue formulado en 1803 por John Dalton, quien imaginaba a los átomos como diminutas esferas.[26] Este primer modelo atómico postulaba:
- La materia está formada por partículas muy pequeñas llamadas átomos, que son indivisibles y no se pueden destruir.
- Los átomos de un mismo elemento son iguales entre sí, tienen su propio peso y cualidades propias. Los átomos de los diferentes elementos tienen pesos diferentes.
- Los átomos permanecen sin división, aun cuando se combinen en las reacciones químicas.
- Los átomos, al combinarse para formar compuestos guardan relaciones simples.
- Los átomos de elementos diferentes se pueden combinar en proporciones distintas y formar más de un compuesto.
- Los compuestos químicos se forman al unirse átomos de dos o más elementos distintos.
Sin embargo desapareció ante el modelo de Thomson ya que no explica los rayos catódicos, la radioactividad ni la presencia de los electrones (e-) o protones (p+).
 |
 |
Modelo de Thomson
[editar]
Luego del descubrimiento del electrón en 1897 por Joseph John Thomson, se determinó que la materia se componía de dos partes, una negativa y una positiva. La parte negativa estaba constituida por electrones, los cuales se encontraban, según este modelo, inmersos en una masa de carga positiva a manera de pasas en un pastel (de la analogía del inglés plum-pudding model) o uvas en gelatina. Posteriormente Jean Perrin propuso un modelo modificado a partir del de Thomson donde las «pasas» (electrones) se situaban en la parte exterior del «pastel» (protones).
Para explicar la formación de iones, positivos y negativos, y la presencia de los electrones dentro de la estructura atómica, Thomson ideó un átomo parecido a un pastel de frutas. Una nube positiva que contenía las pequeñas partículas negativas (los electrones) suspendidos en ella. El número de cargas negativas era el adecuado para neutralizar la carga positiva. En el caso de que el átomo perdiera un electrón, la estructura quedaría positiva; y si ganaba, la carga final sería negativa. De esta forma, explicaba la formación de iones; pero dejó sin explicación la existencia de las otras radiaciones.
Modelo de Nagaoka
[editar]Hantarō Nagaoka rechazó el modelo de Thomson, debido a que las cargas son impenetrables por la opuesta de cada una. Debido a su disconformidad propuso un modelo alternativo en el que un centro de carga positiva estaba rodeado por un número de electrones que giraban, haciendo el símil con Saturno y sus anillos.
En 1904 Nagaoka desarrolló uno de los primeros modelos planetarios del átomo. 1 Tales como el Modelo atómico de Rutherford. El Modelo de Nagaoka estaba basado alrededor de la analogía con el planeta Saturno, y con las teorías que explicaban la estabilidad y relaciones gravitatorias entre este y sus anillos. La cuestión era esta: los anillos son muy estables porque el planeta que orbitan es muy masivo. Este modelo ofrecía dos predicciones:
Un núcleo muy masivo (en analogía a un planeta muy masivo). Electrones girando alrededor del núcleo atómico, atados a esa órbita por las fuerzas electrostáticas (en analogía a los anillos girando alrededor de Saturno, atados a este por su fuerza gravitatoria).
Modelo de Rutherford
[editar]
Este modelo fue desarrollado por el físico Ernest Rutherford a partir de los resultados obtenidos en lo que hoy se conoce como el experimento de Rutherford en 1911. Representa un avance sobre el modelo de Thomson, ya que mantiene que el átomo se compone de una parte positiva y una negativa. Sin embargo, a diferencia del anterior, postula que la parte positiva se concentra en un núcleo, el cual también contiene virtualmente toda la masa del átomo, mientras que los electrones se ubican en una corteza orbitando al núcleo en órbitas circulares o elípticas con un espacio vacío entre ellos. A pesar de ser un modelo obsoleto, es la percepción más común del átomo del público no científico.
Rutherford predijo la existencia del neutrón en el año 1920, por esa razón en el modelo anterior (Thomson), no se habla de este.
Por desgracia, el modelo atómico de Rutherford presentaba varias incongruencias:
- Contradecía las leyes del electromagnetismo de James Clerk Maxwell, las cuales estaban muy comprobadas mediante datos experimentales. Según las leyes de Maxwell, una carga eléctrica en movimiento (en este caso el electrón) debería emitir energía constantemente en forma de radiación y llegaría un momento en que el electrón caería sobre el núcleo y la materia se destruiría. Todo ocurriría muy brevemente.
- No explicaba los espectros atómicos.
Modelo de Bohr
[editar]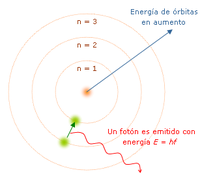
Este modelo es estrictamente un modelo del átomo de hidrógeno tomando como punto de partida el modelo de Rutherford. Niels Bohr trata de incorporar los fenómenos de absorción y emisión de los gases, así como la nueva teoría de la cuantización de la energía desarrollada por Max Planck y el fenómeno del efecto fotoeléctrico observado por Albert Einstein.
«El átomo es un pequeño sistema solar con un núcleo en el centro y electrones moviéndose alrededor del núcleo en órbitas bien definidas». Las órbitas están cuantizadas (los electrones pueden estar solo en ciertas órbitas)
- Cada órbita tiene una energía asociada. La más externa es la de mayor energía.
- Los electrones no irradian energía (luz) mientras permanezcan en órbitas estables.
- Los electrones pueden saltar de una a otra órbita. Si lo hace desde una de menor energía a una de mayor energía absorbe un cuanto de energía (una cantidad) igual a la diferencia de energía asociada a cada órbita. Si pasa de una de mayor a una de menor, pierde energía en forma de radiación (luz).
El mayor éxito de Bohr fue dar la explicación al espectro de emisión del hidrógeno, pero solo la luz de este elemento proporciona una base para el carácter cuántico de la luz, el fotón es emitido cuando un electrón cae de una órbita a otra, siendo un pulso de energía radiada.
Bohr no pudo explicar la existencia de órbitas estables y para la condición de cuantización.
Bohr encontró que el momento angular del electrón es h/2π por un método que no pudo justificar.
Modelo de Sommerfeld
[editar]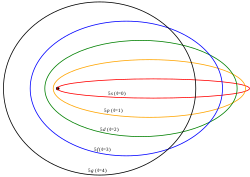
El modelo atómico de Bohr funcionaba muy bien para el átomo de hidrógeno, sin embargo, en los espectros realizados para átomos de otros elementos se observaba que electrones de un mismo nivel energético tenían distinta energía, mostrando que existía un error en el modelo. Su conclusión fue que dentro de un mismo nivel energético existían subniveles, es decir, energías ligeramente diferentes. Además desde el punto de vista teórico, Sommerfeld había encontrado que en ciertos átomos las velocidades de los electrones alcanzaban una fracción apreciable de la velocidad de la luz. Sommerfeld estudió la cuestión para electrones relativistas.
El físico alemán finalmente Arnold Sommerfeld, con la ayuda de la teoría de la relatividad de Albert Einstein, hizo las siguientes modificaciones del modelo de Bohr:
- Los electrones se mueven alrededor del núcleo, en órbitas circulares o elípticas.
- A partir del segundo nivel energético existen dos o más subniveles en el mismo nivel.
- El electrón es una corriente eléctrica minúscula.
En consecuencia, el modelo atómico de Sommerfeld es una generalización del modelo atómico de Bohr desde el punto de vista relativista, aunque no pudo demostrar las formas de emisión de las órbitas elípticas, solo descartó su forma circular.
Modelo de Schrödinger
[editar]
Después de que Louis-Victor de Broglie propuso la naturaleza ondulatoria de la materia en 1924, la cual fue generalizada por Erwin Schrödinger en 1926, se actualizó nuevamente el modelo del átomo.
En el modelo de Schrödinger se abandona la concepción de los electrones como esferas diminutas con carga que giran en torno al núcleo, que es una extrapolación de la experiencia a nivel macroscópico hacia las diminutas dimensiones del átomo. En vez de esto, Schrödinger describe a los electrones por medio de una función de onda, el cuadrado de la cual representa la probabilidad de presencia en una región delimitada del espacio. Esta zona de probabilidad se conoce como orbital. La gráfica siguiente muestra los orbitales para los primeros niveles de energía disponibles en el átomo de hidrógeno.
Modelo de Dirac
[editar]El modelo de Dirac usa supuestos muy similares al modelo de Schrödinger aunque su punto de partida es una ecuación relativista para la función de onda, la ecuación de Dirac. El modelo de Dirac permite incorporar de manera más natural el espín del electrón. Predice niveles energéticos similares al modelo de Schrödinger proporcionando las correcciones relativistas adecuadas.
Modelos posteriores
[editar]Tras el establecimiento de la ecuación de Dirac, la teoría cuántica evolucionó hasta convertirse propiamente en una teoría cuántica de campos. Los modelos surgidos a partir de los años 1960 y 1970 permitieron construir teorías de las interacciones de los nucleones. La vieja teoría atómica quedó confinada a la explicación de la estructura electrónica que sigue siendo explicada de manera adecuada mediante el modelo de Dirac complementado con correcciones surgidas de la electrodinámica cuántica. Debido a la complicación de las interacciones fuertes solo existen modelos aproximados de la estructura del núcleo atómico. Entre los modelos que tratan de dar cuenta de la estructura del núcleo atómico están el modelo de la gota líquida y el modelo de capas.
Posteriormente, a partir de los años 1960 y 1970, aparecieron evidencias experimentales y modelos teóricos que sugerían que los propios nucleones (neutrones, protones) y mesones (piones) que constituyen el núcleo atómico estarían formados por constituyentes fermiónicos más elementales denominados quarks. La interacción fuerte entre quarks entraña problemas matemáticos complicados, algunos aún no resueltos de manera exacta. En cualquier caso lo que se conoce hoy en día deja claro que la estructura del núcleo atómico y de las propias partículas que forman el núcleo son mucho más complicadas que la estructura electrónica de los átomos. Dado que las propiedades químicas dependen exclusivamente de las propiedades de la estructura electrónica, se considera que las teorías actuales explican satisfactoriamente las propiedades químicas de la materia, cuyo estudio fue el origen del estudio de la estructura atómica.
Véase también
[editar]Notas
[editar]Referencias
[editar]- ↑ Ghosh, D. C.; Biswas, R. (2002). «Theoretical calculation of Absolute Radii of Atoms and Ions. Part 1. The Atomic Radii». Int. J. Mol. Sci. 3: 87-113. doi:10.3390/i3020087.
- ↑ Real Academia Española. «átomo». Diccionario de la lengua española (23.ª edición). Consultado el 20 de julio de 2009.
- ↑ Marx, Karl (18 de enero de 2021). Diferencia entre la filosofía de la naturaleza de Demócrito y la de Epicuro. Greenbooks editore. ISBN 979-12-5971-035-2. Consultado el 8 de diciembre de 2023.
- ↑ «Atom». Compendium of Chemical Terminology (IUPAC Gold Book). IUPAC. Consultado el 25 de abril de 2015.
- ↑ «Resumen de Salud Pública: Radiación ionizante» (PDF). Departamento de Salud y Servicios Humanos - Agencia para Sustancias Tóxicas y el Registro de Enfermedades (USA). septiembre de 1999. Consultado el 28 de agosto de 2022.
- ↑ Di Risio, Cecilia D.; Roverano, Mario; Vasquez, Isabel M. (2018). Química Básica (6ta edición). Buenos Aires, Argentina: Universidad De Buenos Aires. pp. 58-59. ISBN 9789508070395.
- ↑ Leigh, G. J., ed. (1990). International Union of Pure and Applied Chemistry, Commission on the Nomenclature of Inorganic Chemistry, Nomenclature of Organic Chemistry – Recommendations 1990. Oxford: Blackwell Scientific Publications. p. 35. ISBN 0-08-022369-9. «An atom is the smallest unit quantity of an element that is capable of existence whether alone or in chemical combination with other atoms of the same or other elements.»
- ↑ Longair, Malcolm S. (10 de febrero de 1999). La evolución de nuestro universo. Ediciones AKAL. ISBN 9788483230312. Consultado el 6 de febrero de 2018.
- ↑ Haubold, Hans; Mathai, A. M. (1998). «Microcosmos: From Leucippus to Yukawa». Structure of the Universe. Common Sense Science. Archivado desde el original el 1 de octubre de 2008. Consultado el 17 de enero de 2008.
- ↑ Harrison (2003:123-139).
- ↑ Este es el radio de la distribución de carga observada en los nucleones. Véase Cottingham y Greenwood, 2004, §3.1.
- ↑ La fórmula exacta es 1,12 ³√A fm. Véase Cottingham y Greenwood, 2004, §4.3.
- ↑ Kramer, 1988, p. 80.
- ↑ Kramer, 1988, p. 67,68.
- ↑ «Nuclear wallets results. Z=82». 2012. (Recopilado por el National Nuclear Data Center). Citan también como estable el bismuto-209, pero existe evidencia de que es inestable. Véase Marcillac, Pierre de; Noël Coron, Gérard Dambier, Jacques Leblanc, Jean-Pierre Moalic (abril de 2003). «Experimental detection of α-particles from the radioactive decay of natural bismuth». Nature 422 (6934): 876-878. Bibcode:2003Natur.422..876D. ISSN 0028-0836. PMID 12712201. doi:10.1038/nature01541.
- ↑ Para el radio atómico, véase Demtröder, 2006, §2.4, §6.2.3.
- ↑ Feynman, Richard; Leighton, R.; Sands, M. (1970). The Feynman lectures on Physics (en inglés) 1. p. 1-3. ISBN 0-201-02115-3.
- ↑ Un estudio de los efectos responsables de la estructura fina e hiperfina en los átomos hidrogenoides puede encontrarse en Bransden y Joachain, 1983, §5.
- ↑ Rañada, Antonio (1990), Dinámica Clásica. Madrid, Alianza Editorial, S. A. 84-206-8133-4
- ↑ Bransden, B. H. y C. J. Joachain (1992), Physics of Atomos and Molecules. Harlow-Essex-England, Longman Group Limited. 0-582-44401-2
- ↑ presocraticos/Atomistas/atomis.html Filósofos Presocráticos: Atomistas, Leucipo y Demócrito
- ↑ Protagonistas de la revolución: Lavoisier, A.L.
- ↑ Amedeo Avogadro Archivado el 4 de marzo de 2016 en Wayback Machine. (en italiano)
- ↑ Elements and Atoms: Chapter 12: Mendeleev's First Periodic Table (en inglés)
- ↑ Experimento de Rutherford
- ↑ Rincón Arce, Álvaro (1983) ABC de Química Primer Curso, Editorial Herrero, México, ISBN 968-420-294-6.
Bibliografía
[editar]- «Teaching Standard Model at high school» (en inglés). Cronología del modelo atómico.
- Sokolovsky, Silvia (2002). «El Átomo». Archivado desde el original el 5 de octubre de 2011..
- Bransden, B.H.; Joachain, J.C. (1983). Physics of atoms and molecules (en inglés). Longman Group Limited. ISBN 0-582-44401-2.
- Cottingham, W.N.; Greenwood, D.A. (2004). An introduction to nuclear physics (en inglés). Cambridge University Press. ISBN 0-521-65149-2.
- Demtröder, Wolfgang (2006). Atoms, molecules and photons (en inglés). Springer-Verlag. ISBN 978-3-540-20631-6.
- Kramer, Kenneth (1988). Introductory nuclear physics (en inglés). ISBN 047180553X.
- «Los ladrillos del Universo: los bloques constituyentes de la materia». Archivado desde el original el 8 de febrero de 2009. Material divulgativo del CERN.
Enlaces externos
[editar] Wikimedia Commons alberga una galería multimedia sobre Átomo.
Wikimedia Commons alberga una galería multimedia sobre Átomo. Wikcionario tiene definiciones y otra información sobre átomo.
Wikcionario tiene definiciones y otra información sobre átomo. Wikiquote alberga frases célebres de o sobre Átomo.
Wikiquote alberga frases célebres de o sobre Átomo.
- El Diccionario de la Real Academia Española tiene una definición para átomo.
