Diferencia entre revisiones de «Metanol»
m Revertidos los cambios de 189.192.116.85 a la última edición de LucienBOT |
|||
| Línea 35: | Línea 35: | ||
== Precauciones == |
== Precauciones == |
||
En concentraciones elevadas el metanol puede causar |
En concentraciones elevadas el metanol puede causar dolor de cabeza, mareo, náusea, vómitos y muerte (la ingestión de 25 g se trata de una dósis mortal). Una exposición aguda puede causar ceguera o pérdida de la visión, ya que puede dañar seriamente el nervio óptico. Una exposición crónica puede ser causa de daños al hígado o de [[cirrosis]]. La dosis letal de metanol para los humanos varía entre 0,3 gramos y 1 gramo por kilogramo de masa corpórea. |
||
El metanol, a pesar de su toxicidad, es muy importante en la fabricación de medicinas. |
El metanol, a pesar de su toxicidad, es muy importante en la fabricación de medicinas. |
||
Revisión del 19:42 13 ene 2010
| Metanol | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| Metanol | ||
| General | ||
| Otros nombres | Carbinol; Alcohol metílico; Alcohol de madera; Espíritu de madera. | |
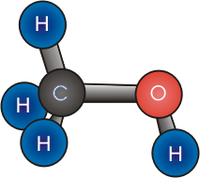
| Fórmula semidesarrollada | CH3-OH | |
| Fórmula estructural | Ver imagen. | |
| Fórmula molecular | CH4O | |
| Identificadores | ||
| Número CAS | 67-56-1[1] | |
| Número RTECS | PC1400000 | |
| ChEBI | 17790 | |
| ChEMBL | CHEMBL14688 | |
| ChemSpider | 864 | |
| PubChem | 887 | |
| UNII | Y4S76JWI15 | |
| KEGG | C00132 D02309, C00132 | |
| Propiedades físicas | ||
| Apariencia | Incoloro | |
| Densidad | 791,8 kg/m³; 0,7918 g/cm³ | |
| Masa molar | 32,04 g/mol | |
| Punto de fusión | 176 K (−97 °C) | |
| Punto de ebullición | 337,8 K (65 °C) | |
| Viscosidad | 0.59 mPa·s a 20 °C. | |
| Propiedades químicas | ||
| Acidez | ~ 15.5 pKa | |
| Solubilidad en agua | totalmente miscible. | |
| Producto de solubilidad | n/d | |
| Momento dipolar | 1.69 D | |
| Peligrosidad | ||
| Punto de inflamabilidad | 285 K (12 °C) | |
| Temperatura de autoignición | 658 K (385 °C) | |
| Riesgos | ||
| Ingestión | Puede producir ceguera,sordera y muerte | |
| Inhalación | Por evaporación de esta sustancia a 20 °C, puede alcanzarse bastante rápidamente una concentración nociva en el aire. | |
| Piel | Puede producir dermatitis. | |
| Ojos | Irritación. | |
| Compuestos relacionados | ||
| Alcoholes | Etanol | |
| Otros | Metanal | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El compuesto químico metanol, también conocido como alcohol metílico o alcohol de madera, es el alcohol más sencillo. A temperatura ambiente se presenta como un líquido ligero (de baja densidad), incoloro, inflamable y tóxico que se emplea como anticongelante, disolvente y combustible. Su fórmula química es CH3OH.
Precauciones
En concentraciones elevadas el metanol puede causar dolor de cabeza, mareo, náusea, vómitos y muerte (la ingestión de 25 g se trata de una dósis mortal). Una exposición aguda puede causar ceguera o pérdida de la visión, ya que puede dañar seriamente el nervio óptico. Una exposición crónica puede ser causa de daños al hígado o de cirrosis. La dosis letal de metanol para los humanos varía entre 0,3 gramos y 1 gramo por kilogramo de masa corpórea.
El metanol, a pesar de su toxicidad, es muy importante en la fabricación de medicinas.
Usos
El metanol tiene varios usos. Es un disolvente industrial y se emplea como materia prima en la fabricación de formaldehído. El metanol también se emplea como anticongelante en vehículos, combustible de bombonas de camping-gas, disolvente de tintas, tintes, resinas, adhesivos y [aspartamo]. El metanol puede ser también añadido al etanol para hacer que éste no sea apto para el consumo humano (el metanol es altamente tóxico).
Biometanol
En la industria relacionada con la producción de vino, el metanol proviene de la desmetilación enzimática de las pectinas presentes en la pared celular de la uva y, por consiguiente, su concentración en los vinos estará determinada por la concentración de pectinas en el mosto, que depende de la variedad de uva que se emplee, la concentración de enzimas y el grado de actividad de estas últimas.
Además el mundo desarrolla y apuesta por las pila de combustible, se trabaja en su aplicación en base al metanol que puede extraerse de productos vegetales e integraría un proceso de generación natural ecológica y sustentable.
Enlaces externos
- Web experta en el tratamiento de información sobre biocombustibles y en el contacto entre los agentes que intervienen en este sector
- Instituto Nacional de Seguridad e Higiene en el Trabajo de España: Ficha internacional de seguridad química del metanol.
