Electrólisis

La electrólisis o electrolisis es el proceso que separa los elementos de un compuesto por medio de la electricidad.[1] En ella ocurre la liberación de electrones por los aniones en el ánodo (una oxidación) y la captura de electrones por los cationes en el cátodo (una reducción). Este proceso se lleva a cabo en una clase importante de celdas electroquímicas que se conocen como celdas electrolíticas, donde se usa una corriente eléctrica para activar una reacción no espontánea, como resultado, los dos elementos del agua (Hidrógeno y Oxígeno) se separan. La electrólisis se basa en los mismos principios en que se fundamentan los procesos que se realizan en las celdas galvánicas.
Una celda galvánica convierte energía química en energía eléctrica, cuando una reacción con valor positivo de E (valor negativo de G) procede hacia el equilibrio; una celda electrolítica convierte energía eléctrica en energía química cuando una corriente eléctrica impulsa una reacción con valor negativo de E (y valor positivo de G) en dirección que se aleja del equilibrio. Así, los procesos que suceden en celdas galvánicas y electrolíticas son inversos entre sí. El proceso de usar una corriente eléctrica para producir un cambio se conoce como electrólisis.
Historia[editar]
Fue descubierta accidentalmente en 1800 por William Nicholson mientras estudiaba el funcionamiento de las baterías. En 1834 el físico y químico inglés Michael Faraday desarrolló y publicó las leyes de la electrólisis que llevan su nombre y acuñó los términos.
A principios del siglo XIX, William Nicholson y Anthony Carlisle intentaron profundizar en los experimentos de Volta. Fijaron dos alambres a cada lado de una pila voltaica y colocaron los otros extremos en un tubo lleno de agua. Observaron que, al juntar los alambres, cada uno de ellos producía burbujas. Un tipo era de hidrógeno y el otro de oxígeno.[2]
En 1785 un científico neerlandés llamado Martin van Marum creó un generador electrostático que utilizó para reducir estaño, zinc y antimonio a partir de sus sales mediante un proceso conocido posteriormente como electrólisis. Aunque sin saberlo produjo la electrólisis, no fue hasta 1800 cuando William Nicholson y Anthony Carlisle descubrieron el funcionamiento de la electrólisis.[3]
En 1791 Luigi Galvani experimentó con ancas de rana. Afirmó que colocando músculo animal entre dos láminas metálicas disímiles se producía electricidad. En respuesta a estas afirmaciones, Alessandro Volta realizó sus propias pruebas.[4][5] Esto daría luz a las ideas de Humphry Davy sobre la electrólisis. Durante los experimentos preliminares, Humphry Davy planteó la hipótesis de que cuando dos elementos se combinan para formar un compuesto, se libera energía eléctrica. Humphry Davy crearía las Tablas de Descomposición a partir de sus experimentos preliminares sobre la electrólisis. Las Tablas de Descomposición darían una idea de las energías necesarias para descomponer ciertos compuestos.[6]
En 1817 Johan August Arfwedson determinó que había otro elemento, el litio, en algunas de sus muestras; sin embargo, no pudo aislar el componente. No fue hasta 1821 cuando William Thomas Brande utilizó la electrólisis para individualizarlo. Dos años más tarde, perfeccionó el proceso utilizando cloruro de litio y cloruro de potasio con electrólisis para producir litio e hidróxido de litio.[7][8]
Durante los últimos años de investigación de Humphry Davy, Michael Faraday se convirtió en su ayudante. Mientras estudiaba el proceso de electrólisis bajo Humphry Davy, Michael Faraday descubrió dos leyes de la electrólisis.[5]
Durante la época de Maxwell y Faraday, surgió la preocupación por las actividades electropositivas y electronegativas.[9]
En noviembre de 1875, Paul Émile Lecoq de Boisbaudran descubrió el galio mediante electrólisis de hidróxido de galio, produciendo 3,4 mg de galio. En diciembre siguiente, presentó su descubrimiento del galio a la Académie des sciences de París.[10]
El 26 de junio de 1886, Ferdinand Frederick Henri Moissan finalmente se sintió cómodo realizando electrólisis en fluoruro de hidrógeno anhidro para crear un elemento puro de flúor gaseoso. Antes de utilizar el fluoruro de hidrógeno, Henri Moissan utilizaba sales de fluoruro con electrólisis. Así, el 28 de junio de 1886, realizó su experimento frente a la Académie des sciences para mostrar su descubrimiento del nuevo elemento flúor.[11] Mientras intentaban encontrar flúor elemental mediante electrólisis de sales de flúor, muchos químicos perecieron, entre ellos Paulin Louyet y Jérôme Nicklès.[12]
En 1886 Charles Martin Hall de Estados Unidos y Paul Héroult de Francia solicitaron patentes estadounidenses para la electrólisis del aluminio, Héroult presentó la suya en mayo y Hall, en julio.[13] Hall pudo conseguir su patente demostrando mediante cartas a su hermano y pruebas familiares que su método había sido descubierto antes de que se presentara la patente francesa.[14] Esto se conoció como el proceso Hall-Héroult que benefició a muchas industrias porque el precio del aluminio bajó entonces de cuatro dólares a treinta centavos por libra.[15]
Etimología[editar]
La palabra "electrólisis" fue introducida por Michael Faraday en 1834,[16] utilizando el Griego palabras ἤλεκτρον ɛ̌ːlektron "ámbar", que desde el siglo XVII se asociaba a fenómenos eléctricos, y λύσις. lýsis que significa "disolución". No obstante, la electrólisis, como herramienta para estudiar reacciones químicas y obtener elementos puros, es anterior a la acuñación del término y descripción formal por Faraday.
Proceso[editar]

- Se aplica una corriente eléctrica continua mediante un par de electrodos conectados a una fuente de alimentación eléctrica y sumergidos en la disolución. El electrodo conectado al polo positivo se conoce como cátodo, y el conectado al negativo como ánodo.[17]
- Cada electrodo atrae a los iones de carga opuesta. Así, los iones negativos, o aniones, son atraídos y se desplazan hacia el cátodo (electrodo positivo), mientras que los iones positivos, o cationes, son atraídos y se desplazan hacia el ánodo (electrodo negativo).
- La manera más fácil de recordar toda esta terminología es fijándose en la raíz griega de las palabras:
- Odos significa camino. Electrodo es el camino por el que van los electrones.
- Catha significa hacia abajo (catacumba, catástrofe). Cátodo es el camino por donde caen los electrones.
- Anas significa hacia arriba. Ánodo es el camino por el que ascienden los electrones.
- Ion significa caminante. Anión se dirige al ánodo y catión se dirige al cátodo.
- La nomenclatura se utiliza también en pilas.
- Una forma fácil también de recordar la terminología es teniendo en cuenta la primera letra de cada electrodo y asociarla al proceso que en él ocurre; es decir: en el ánodo se produce la oxidación (las dos palabras empiezan con vocales) y en el cátodo la reducción (las dos palabras comienzan con consonantes)
- La energía necesaria para separar a los iones e incrementar su concentración en los electrodos es aportada por la fuente de alimentación eléctrica.
- En los electrodos se produce una transferencia de electrones entre estos y los iones, produciéndose nuevas sustancias. Los iones negativos o aniones ceden electrones al ánodo (-) y los iones positivos o cationes toman electrones del cátodo (+)
En definitiva lo que ocurre es una reacción de oxidación-reducción, donde la fuente de alimentación eléctrica se encarga de aportar la energía necesaria.
Obtención por electrólisis[editar]
Electrólisis del agua[editar]
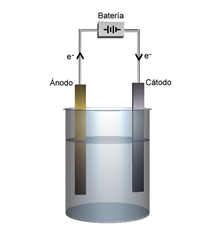
Si el agua no es destilada, la electrólisis no solo separa el oxígeno y el hidrógeno, sino los demás componentes que estén presentes como sales, metales y algunos otros minerales (lo que hace que el agua conduzca la electricidad no es el H2O, sino que son los minerales; si el agua estuviera destilada y fuera 100 % pura, no tendría conductividad).
Es importante hacer varias consideraciones:
- Nunca deben unirse los electrodos, ya que la corriente eléctrica no va a conseguir el proceso y la batería se sobrecalentará y quemará.
- Debe utilizarse siempre corriente continua (energía de baterías o de adaptadores de corriente), nunca corriente alterna (energía del enchufe de la red)
- La electrólisis debe hacerse de tal manera que los dos gases desprendidos no entren en contacto, de lo contrario producirían una mezcla peligrosamente explosiva (ya que el oxígeno y el hidrógeno resultantes se encuentran en proporción estequiométrica)
- Una manera de producir agua otra vez, es mediante la exposición a un catalizador. El más común es el calor; otro es el platino en forma de lana fina o polvo. El segundo caso debe hacerse con mucho cuidado, incorporando cantidades pequeñas de hidrógeno en presencia de oxígeno y el catalizador, de manera que el hidrógeno se queme suavemente, produciendo una llama tenue. Lo contrario nunca debe hacerse sin debida investigación y ayuda profesional.
Electrólisis del cloruro de sodio fundido[editar]
En su fase fundida, el cloruro de sodio (un compuesto iónico) se puede electrolizar para formar sodio metálico y cloro. En el NaCl fundido, los cationes y los aniones son los iones Na+ y Cl-, respectivamente. La figura que se muestra debajo, es un diagrama simplificado que muestra las reacciones que tienen lugar en los electrodos. La celda electrolítica contiene un par de electrodos conectados a una batería. Ésta funciona como una «bomba de electrones» que los lleva hacia el cátodo, donde se efectúa la reducción y los retira del ánodo, donde se realiza la oxidación. Las reacciones en los electrodos son:

Este proceso es la fuente principal de sodio metálico puro y de gas cloro. Los cálculos teóricos indican que el valor de E° para el proceso global es de aproximadamente -4 V, lo que significa que este proceso es no espontáneo. Por consiguiente, la batería debe suministrar un mínimo de 4 V para que la reacción se lleve a cabo. En la práctica, sin embargo, se necesita un voltaje mayor debido a la ineficiencia del proceso electrolítico y al sobrevoltaje.[18]

Aplicaciones comerciales[editar]


- Producción de aluminio, sodio, potasio, y magnesio.
- Producción de hidróxido de sodio, ácido clorhídrico, clorato de sodio y clorato de potasio.
- Producción de hidrógeno con múltiples usos en la industria: como combustible, en soldaduras, entre otros. Ver más en hidrógeno diatómico.
- La electrólisis de una solución salina permite producir hipoclorito (lejía): este método se emplea para conseguir una cloración ecológica del agua de las piscinas.
- La electrometalurgia es un proceso para separar el metal puro de compuestos usando la electrólisis. Por ejemplo, el hidróxido de sodio es separado en sodio puro, oxígeno puro e hidrógeno puro.
- La anodización es usada para proteger los metales de la corrosión.
- La galvanoplastia, también usada para evitar la corrosión de metales, crea una película delgada de un metal menos corrosible sobre otro penco.
Fabricación del sodio[editar]

El sodio metálico se produce en la industria en celdas Downs, electrolizando una mezcla fundida de cloruro de sodio y cloruro de calcio. La presencia de CaCl2 permite que la celda funcione a menor temperatura, porque el punto de fusión aproximado de la mezcla de NaCl-CaCl2 (aproximadamente 580 °C) es bastante menor que el del NaCl puro (801 °C). El sodio líquido producido en el cátodo cilíndrico de acero es menos denso que la sal fundida, de manera que flota en la parte superior de la cela, de donde se saca y llega a un recipiente adecuado. En el ánodo de grafito, que está separado del cátodo por una reja de hierro que mantiene alejados los productos, se forma el cloro gaseoso.
En vista de que el proceso Downs requiere grandes corrientes (por lo general, de 25,000 a 40,000 A), las plantas productoras de sodio están cerca de fuentes de energía hidroeléctrica poco costosa, como es el caso de las Cataratas del Niágara, Nueva York.[19]
Fabricación de cloro e hidróxido de sodio[editar]
La producción de cloro e hidróxido de sodio por electrólisis de cloruro de sodio es la base de la industria cloro-sosa, que en Estados Unidos genera ventas aproximadas por 4000 millones de dólares. Tanto el cloro como el hidróxido de sodio están entre las principales sustancias químicas en términos de producción: la producción anual estadounidense es de unos 13 millones de toneladas de cloro y de 10 millones de toneladas de hidróxido de sodio. El cloro se usa en el tratamiento de agua y aguas residuales, como blanqueador en la fabricación del papel y en la fabricación de plásticos como el cloruro de polivinilo (PVC). El hidróxido de sodio se emplea en la fabricación de papel, textiles, jabones y detergentes.
La figura que se muestra debajo muestra las propiedades esenciales de una celda de membrana para la producción industrial de cloro e hidróxido de sodio. Una disolución acuosa saturada de cloruro de sodio (salmuera) entra al compartimento anódico, donde el Cl- se oxida a Cl2 gaseoso, y entra agua al compartimento del cátodo, donde se convierte en H2 gaseoso y iones OH-. Entre los compartimentos del ánodo y el cátodo está instalada una membrana especial de plástico, permeable sólo a los cationes, pero no a los aniones ni al agua. La membrana mantiene separados al Cl2 y a los iones OH-, aunque permite el paso de una corriente de iones Na+ hacia el compartimento del cátodo, conduciendo así la corriente en la disolución y manteniendo la neutralidad eléctrica en ambos compartimentos. Los iones Na+ y OH- salen del compartimento del cátodo en forma de una disolución acuosa de NaOH.[20]

.
Referencias[editar]
- ↑ Real Academia Española. «electrólisis». Diccionario de la lengua española (23.ª edición).
- ↑ Fabbri, Emiliana; Schmidt, Thomas J. (5 de octubre de 2018). «Reacción de evolución del oxígeno-El enigma de la electrólisis del agua». ACS Catalysis 8 (10): 9765-9774. doi:10.1021/acscatal.8b02712.
- ↑ Ashworth, William (20 de marzo de 2015). «Martinus van Marum - Científico del día». Linda Hall Library.
- ↑ Ihde, Aaron J. (1964). El desarrollo de la química moderna. Harper & Row. pp. 125-127.
- ↑ a b «La historia de la electroquímica: De Volta a Edison». ECS (en inglés estadounidense). Consultado el 11 de octubre de 2019.
- ↑ Thorpe, Thomas (1896). Humphry Davy, Poeta y Filósofo. New York: Macmillan & Co., Limited.
- ↑ «Litio - periodicstats.com». www.periodicstats.com. Archivado desde el original el 15 de abril de 2021.
- ↑ Helmenstine, Todd (11 de enero de 2018). «Hoy en la historia de la ciencia - 12 de enero - Johan August Arfwedson y el litio». Notas y proyectos científicos.
- ↑ Ede, Andrew (2017). A History of Science in Society (3rd edición). Toronto, Canada: University of Toronto Press. p. 251. ISBN 978-1-4426-3499-2.
- ↑ Marshall, James y Virginia. «Rediscovery of the Elements - Gallium». University of North Texas. Archivado desde el original el 9 de octubre de 2022.
- ↑ Wisniak, Jaime (26 de agosto de 2018). «Henri Moissan: El descubridor del flúor». Educación Química 13 (4): 267. ISSN 1870-8404. S2CID 92299077. doi:10.22201/fq.18708404e.2002.4.66285.
- ↑ Marshall, James y Virginia. «Rediscovery of the Elements- Fluorine and Henri Moissan». Universidad del Norte de Texas. Archivado desde el original el 9 de octubre de 2022.
- ↑ Beck, Theodore R. (21 de agosto de 2015). «ECS Classics: Hall y Héroult y el descubrimiento de la electrólisis del aluminio». ECS. Interface.
- ↑ html Proceso Hall de producción y comercialización del aluminio - National Historic Chemical Landmark (en inglés). Oberlin, Ohio: American Chemical Society. 1997.
- ↑ «Paul Héroult y Charles M. Hall». Science History Institute (en inglés). 1 de junio de 2016.
- ↑ Oesper, Ralph; Speter, Max (1937). «La correspondencia Faraday-Whewell sobre términos electroquímicos». The Scientific Monthly 45 (6): 535-546. Bibcode:.45..535O 1937SciMo. .45..535O.
- ↑ Física/Physics en Google libros.
- ↑ Chang, Raymond; Goldsby, Kenneth A. (2013). Química. McGRAW-HILL/INTERAMERICANA EDITORES, S.A. DE C.V. ISBN 978-607-15-0928-4.
- ↑ McMURRY E., JOHN y FAY C., ROBERT, Química general (2009). «17». En Rubén Fuerte Rivera, ed. Química general. PEARSON EDUCACIÓN,. p. 719. ISBN 978-970-26-1286-5.
- ↑ McMURRY E., JOHN y FAY C., ROBERT (2009). «17». En Rubén Fuerte Rivera, ed. Química General. PEARSON EDUCACIÓN,. p. 719. ISBN 978-970-26-1286-5.
Enlaces externos[editar]
 Wikimedia Commons alberga una galería multimedia sobre Electrólisis.
Wikimedia Commons alberga una galería multimedia sobre Electrólisis.

