Electroforesis en gel de agarosa

La electroforesis en gel de agarosa es un método de electroforesis en gel utilizado en bioquímica, biología molecular, genética y química clínica para separar una población mixta de macromoléculas, como ADN o proteínas, en una matriz de agarosa, uno de los dos componentes principales del agar. Las proteínas pueden separarse por carga y/o tamaño (la electroforesis de agarosa con enfoque isoeléctrico es esencialmente independiente del tamaño), y los fragmentos de ADN y ARN por longitud.[1] Las biomoléculas se separan aplicando un campo eléctrico para mover las moléculas cargadas a través de una matriz de agarosa, y las biomoléculas se separan por tamaño en la matriz de gel de agarosa.[2]
El gel de agarosa es fácil de moldear, tiene relativamente menos grupos cargados y es especialmente adecuado para separar ADN del rango de tamaños más frecuente en los laboratorios, lo que explica la popularidad de su uso. El ADN separado puede visualizarse con tinción, normalmente bajo luz ultravioleta, y los fragmentos de ADN pueden extraerse del gel con relativa facilidad. La mayoría de los geles de agarosa utilizados se disuelven entre el 0,7 y el 2% en un tampón de electroforesis adecuado.
Propiedades del gel de agarosa[editar]
El gel de agarosa es una matriz tridimensional formada por moléculas helicoidales de agarosa en haces superenrollados que se agregan en estructuras tridimensionales con canales y poros a través de los cuales pueden pasar las biomoléculas.[3] La estructura tridimensional se mantiene unida mediante enlaces de hidrógeno y, por lo tanto, puede romperse calentándola hasta que vuelva a su estado líquido. La temperatura de fusión es diferente de la temperatura de gelificación, dependiendo de las fuentes, el gel de agarosa tiene una temperatura de gelificación de 35-42 °C y una temperatura de fusión de 85-95 °C. También existen agarosas de baja fusión y baja gelificación fabricadas mediante modificaciones químicas.
El gel de agarosa tiene un gran tamaño de poro y una buena resistencia de gel, lo que lo hace adecuado como medio anticonvección para la electroforesis de ADN y grandes moléculas de proteínas. El tamaño de poro de un gel al 1% se ha estimado entre 100 nm y 200-500 nm,[4][5] y su fuerza de gel permite que geles tan diluidos como el 0,15% formen una losa para electroforesis en gel.[6] Sin embargo, los geles de baja concentración (0,1-0,2%) son frágiles y, por tanto, difíciles de manipular. El gel de agarosa tiene un menor poder de resolución que el gel de poliacrilamida para el ADN, pero tiene un mayor rango de separación, por lo que se utiliza para fragmentos de ADN de un tamaño generalmente entre 50 y 20.000 pb. El límite de resolución para la electroforesis estándar en gel de agarosa es de unos 750 kb, pero es posible una resolución de más de 6 Mb con la electroforesis en gel de campo pulsado (PFGE).[7] También puede utilizarse para separar proteínas de gran tamaño, y es la matriz preferida para la electroforesis en gel de partículas con radios efectivos superiores a 5-10 nm. Un gel de agarosa al 0,9% tiene poros suficientemente grandes para la entrada del bacteriófago T4.[6]

El polímero de agarosa contiene grupos cargados, en particular piruvato y sulfato.[8] Estos grupos cargados negativamente crean un flujo de agua en dirección opuesta al movimiento del ADN en un proceso denominado electroendosmosis (EEO), por lo que pueden retardar el movimiento del ADN y provocar la difuminación de las bandas. Los geles de mayor concentración tendrían un mayor flujo electroendosmótico. Por lo tanto, generalmente se prefiere la agarosa de baja EEO para su uso en la electroforesis en gel de agarosa de ácidos nucleicos, pero la agarosa de alta EEO puede utilizarse para otros fines. El menor contenido en sulfatos de la agarosa de baja EEO, en particular la agarosa de bajo punto de fusión (LMP), también es beneficioso en los casos en los que el ADN extraído del gel se va a utilizar para manipulaciones posteriores, ya que la presencia de sulfatos contaminantes puede afectar a algunos procedimientos posteriores, como la ligadura y la PCR. Sin embargo, las agarosas sin EEO son indeseables para algunas aplicaciones, ya que pueden fabricarse añadiendo grupos cargados positivamente y dichos grupos pueden afectar a las reacciones enzimáticas posteriores.[9] La electroendosmosis es una razón por la que la agarosa se utiliza preferentemente al agar, ya que el componente de agaropectina en el agar contiene una cantidad significativa de grupos sulfato y carboxilo cargados negativamente. La eliminación de la agaropectina en la agarosa reduce sustancialmente la EEO, así como la adsorción no específica de biomoléculas a la matriz de gel. Sin embargo, para algunas aplicaciones como la electroforesis de proteínas séricas, puede ser deseable una alta EEO, y la agaropectina puede añadirse en el gel utilizado.[10]
Migración de ácidos nucleicos en gel de agarosa[editar]
Factores que afectan a la migración del ácido nucleico en gel[editar]
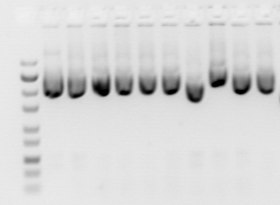
Varios factores pueden afectar a la migración de los ácidos nucleicos: la dimensión de los poros del gel (concentración del gel), el tamaño del ADN electroforizado, el voltaje utilizado, la fuerza iónica del tampón y la concentración del colorante intercalante, como el bromuro de etidio, si se utiliza durante la electroforesis.[11]
Las moléculas más pequeñas se desplazan más rápidamente que las grandes en el gel, y el ADN bicatenario se desplaza a una velocidad inversamente proporcional al logaritmo del número de pares de bases. Sin embargo, esta relación se rompe con fragmentos de ADN muy grandes, y la separación de fragmentos de ADN muy grandes requiere el uso de la electroforesis en gel de campo pulsado (PFGE), que aplica corriente alterna desde diferentes direcciones y los fragmentos de ADN grandes se separan a medida que se reorientan con el cambio de campo.[12]
En la electroforesis en gel de agarosa estándar, las moléculas más grandes se resuelven mejor utilizando un gel de baja concentración, mientras que las moléculas más pequeñas se separan mejor en un gel de alta concentración. Sin embargo, los geles de mayor concentración requieren tiempos de ejecución más largos (a veces días).
El movimiento del ADN puede verse afectado por la conformación de la molécula de ADN, por ejemplo, el ADN superenrollado suele moverse más rápido que el relajado porque está fuertemente enrollado y, por tanto, es más compacto. En una preparación normal de ADN plasmídico, pueden estar presentes múltiples formas de ADN.[13] La electroforesis en gel de los plásmidos mostraría normalmente la forma superenrollada negativa como banda principal, mientras que el ADN mellado (forma circular abierta) y la forma circular cerrada relajada aparecen como bandas menores. Sin embargo, la velocidad a la que se mueven las distintas formas puede cambiar utilizando diferentes condiciones de electroforesis,[14] y la movilidad del ADN circular más grande puede verse más afectada que la del ADN lineal por el tamaño del poro del gel.[15]
El bromuro de etidio que se intercala en el ADN circular puede cambiar la carga, la longitud y la superhelicidad de la molécula de ADN, por lo que su presencia en el gel durante la electroforesis puede afectar a su movimiento. Por ejemplo, la carga positiva del bromuro de etidio puede reducir el movimiento del ADN en un 15%.[12] La electroforesis en gel de agarosa puede utilizarse para resolver ADN circular con diferente topología de superenrollamiento.[16]
El daño en el ADN debido al aumento de la reticulación también reducirá la migración electroforética del ADN de forma dependiente de la dosis.[17][18]
La velocidad de migración del ADN es proporcional al voltaje aplicado, es decir, cuanto mayor es el voltaje, más rápido se mueve el ADN. Sin embargo, la resolución de grandes fragmentos de ADN es menor a alto voltaje. La movilidad del ADN también puede cambiar en un campo inestable: en un campo que se invierte periódicamente, la movilidad del ADN de un tamaño determinado puede disminuir significativamente a una frecuencia de ciclo concreta.[4] Este fenómeno puede dar lugar a la inversión de bandas en la electroforesis en gel con inversión de campo (FIGE), en la que los fragmentos de ADN más grandes se mueven más rápido que los más pequeños.
Anomalías de migración[editar]
- Geles "sonrientes": este efecto de borde se produce cuando el voltaje aplicado es demasiado alto para la concentración de gel utilizada.[19]
- Sobrecarga del ADN: la sobrecarga del ADN ralentiza la migración de los fragmentos de ADN.
- Contaminación: la presencia de impurezas, como sales o proteínas, puede afectar al movimiento del ADN.
Mecanismo de migración y separación[editar]
La carga negativa de su columna vertebral de fosfato mueve el ADN hacia el ánodo cargado positivamente durante la electroforesis. Sin embargo, la migración de las moléculas de ADN en solución, en ausencia de una matriz de gel, es independiente del peso molecular durante la electroforesis.[4][20] La matriz de gel es, por tanto, responsable de la separación del ADN por tamaño durante la electroforesis, y existen varios modelos para explicar el mecanismo de separación de biomoléculas en matriz de gel. Uno ampliamente aceptado es el modelo de Ogston, que trata la matriz polimérica como un tamiz. Una proteína globular o una bobina aleatoria de ADN se mueven a través de los poros interconectados, y es más probable que el movimiento de las moléculas más grandes se vea impedido y ralentizado por las colisiones con la matriz de gel, por lo que las moléculas de diferentes tamaños pueden separarse en este proceso de tamizado.[4]
Sin embargo, el modelo de Ogston no funciona con moléculas grandes, ya que los poros son mucho más pequeños que el tamaño de la molécula. Para moléculas de ADN de tamaño superior a 1 kb, lo más habitual es utilizar un modelo de reptación (o sus variantes). Este modelo supone que el ADN puede arrastrarse en forma de "serpiente" (de ahí lo de "reptación") a través de los poros como una molécula alargada.[21] Sin embargo, la microscopía de fluorescencia en tiempo real de las moléculas teñidas mostró una dinámica más sutil durante la electroforesis, en la que el ADN mostraba una elasticidad considerable, ya que se estiraba alternativamente en la dirección del campo aplicado y luego se contraía en forma de bola, o se enganchaba en forma de U cuando quedaba atrapado en las fibras de polímero.[22][23]
Procedimiento general[editar]
Los detalles de un experimento de electroforesis en gel de agarosa pueden variar según los métodos, pero la mayoría siguen un procedimiento general.
Colada de gel[editar]
El gel se prepara disolviendo el polvo de agarosa en un tampón adecuado, como TAE o TBE, que se utilizará en la electroforesis.[12] La agarosa se dispersa en el tampón antes de calentarlo hasta casi el punto de ebullición, pero evitando que hierva. La agarosa fundida se deja enfriar lo suficiente antes de verter la solución en un molde, ya que éste puede deformarse o agrietarse si la solución de agarosa está demasiado caliente. Se coloca un peine en el molde para crear pocillos para cargar la muestra, y el gel debe estar completamente fraguado antes de su uso.

La concentración del gel afecta a la resolución de la separación del ADN. El gel de agarosa está compuesto por poros microscópicos a través de los cuales se desplazan las moléculas, y existe una relación inversa entre el tamaño de los poros del gel de agarosa y la concentración: el tamaño de los poros disminuye a medida que aumenta la densidad de las fibras de agarosa. Una concentración elevada del gel mejora la separación de las moléculas de ADN más pequeñas, mientras que una concentración menor del gel permite separar las moléculas de ADN grandes.
El proceso permite separar fragmentos que van desde 50 pares de bases hasta varios megabases, dependiendo de la concentración de gel utilizada.[24] La concentración se mide en peso de agarosa sobre volumen de tampón utilizado (g/ml). Para una electroforesis en gel de agarosa estándar, un gel al 0,8% proporciona una buena separación o resolución de fragmentos grandes de ADN de 5-10kb, mientras que un gel al 2% proporciona una buena resolución para fragmentos pequeños de 0,2-1kb. Para una electroforesis estándar se suele utilizar un gel al 1%.[25] Los geles de alto porcentaje suelen ser quebradizos y pueden no cuajar uniformemente, mientras que los geles de bajo porcentaje (0,1-0,2%) son frágiles y no son fáciles de manipular. Los geles de agarosa de bajo punto de fusión (LMP) también son más frágiles que el gel de agarosa normal. La agarosa de bajo punto de fusión puede utilizarse sola o simultáneamente con la agarosa estándar para la separación y el aislamiento del ADN[26] PFGE y FIGE se realizan a menudo con geles de agarosa de alto porcentaje.
Carga de las muestras[editar]
Una vez fraguado el gel, se retira el peine, dejando pocillos en los que pueden cargarse las muestras de ADN. El tampón de carga se mezcla con la muestra de ADN antes de cargar la mezcla en los pocillos. El tampón de carga contiene un compuesto denso, que puede ser glicerol, sacarosa o Ficoll, que eleva la densidad de la muestra para que la muestra de ADN pueda hundirse hasta el fondo del pocillo.[12] Si la muestra de ADN contiene etanol residual después de su preparación, puede flotar fuera del pocillo. El tampón de carga también incluye colorantes como el xilenocianol y el azul de bromofenol que se utilizan para controlar el progreso de la electroforesis. Las muestras de ADN se cargan utilizando una pipeta.
Electroforesis[editar]

La electroforesis en gel de agarosa se suele realizar horizontalmente en un modo subacuático, en el que el gel está completamente sumergido en el tampón durante la electroforesis. También es posible, aunque menos común, realizar la electroforesis verticalmente, así como horizontalmente con el gel elevado sobre patas de agarosa utilizando un aparato apropiado.[27] El tampón utilizado en el gel es el mismo que el tampón de funcionamiento en el tanque de electroforesis, por lo que la electroforesis en el modo subacuático es posible con el gel de agarosa.
Para una resolución óptima de ADN de más de 2 kb de tamaño en electroforesis en gel estándar, se recomiendan de 5 a 8 V/cm (la distancia en cm se refiere a la distancia entre electrodos, por lo que este voltaje recomendado sería de 5 a 8 multiplicado por la distancia entre los electrodos en cm).[14] El voltaje también puede estar limitado por el hecho de que calienta el gel y puede hacer que el gel se derrita si se hace funcionar a alto voltaje durante un periodo prolongado, especialmente si el gel utilizado es gel de agarosa LMP. Un voltaje demasiado alto también puede reducir la resolución, así como provocar la formación de bandas en el caso de moléculas de ADN grandes. Un voltaje demasiado bajo puede provocar un ensanchamiento de la banda en el caso de fragmentos pequeños de ADN debido a la dispersión y la difusión.[28]
Dado que el ADN no es visible a la luz natural, el progreso de la electroforesis se controla mediante colorantes. El xilenocianol (color azul claro) migra con los fragmentos grandes de ADN, mientras que el azul de bromofenol (azul oscuro) migra con los fragmentos más pequeños. Otros colorantes menos utilizados son el rojo cresol y el naranja G, que migran antes que el azul de bromofenol. También se corre un marcador de ADN para estimar el peso molecular de los fragmentos de ADN. Sin embargo, hay que tener en cuenta que el tamaño de un ADN circular como el de los plásmidos no puede medirse con precisión utilizando marcadores estándar a menos que se haya linealizado mediante digestión de restricción.
Tinción y visualización[editar]

El ADN y el ARN se visualizan normalmente mediante tinción con bromuro de etidio, que se intercala en los surcos principales del ADN y es fluorescente bajo la luz ultravioleta. La intercalación depende de la concentración de ADN y, por lo tanto, una banda de alta intensidad indicará una mayor cantidad de ADN en comparación con una banda de menor intensidad.[12] El bromuro de etidio puede añadirse a la solución de agarosa antes de que se gelifique, o el gel de ADN puede teñirse posteriormente tras la electroforesis. No es necesario desteñir el gel, pero puede producir mejores imágenes. Existen otros métodos de tinción; por ejemplo, MIDORI Green, SYBR Green, GelRed, azul de metileno, azul de cresilo brillante, sulfato de azul de Nilo y violeta cristal.[29]SYBR Green, GelRed y otros productos comerciales similares se venden como alternativas más seguras al bromuro de etidio, ya que se ha demostrado que es mutagénico en la prueba de Ames, aunque en realidad no se ha establecido la carcinogenicidad del bromuro de etidio. SYBR Green requiere el uso de un transiluminador de luz azul. El ADN teñido con violeta cristal puede observarse con luz natural sin necesidad de utilizar un transiluminador de luz ultravioleta, lo cual es una ventaja, aunque puede que no produzca una banda intensa.
Cuando se tiñe con bromuro de etidio, el gel se visualiza con un transiluminador ultravioleta (UV). La luz ultravioleta excita los electrones dentro del anillo aromático del bromuro de etidio y, una vez que vuelven al estado fundamental, se libera la luz, haciendo que el complejo de ADN y bromuro de etidio sea fluorescente.[12] Los transiluminadores estándar utilizan longitudes de onda de 302/312 nm (UV-B), pero la exposición del ADN a la radiación ultravioleta durante tan sólo 45 segundos puede dañar el ADN y afectar a los procedimientos posteriores, por ejemplo, reduciendo la eficacia de la transformación, la transcripción in vitro y la PCR.[30] El uso de una longitud de onda superior de 365 nm (rango UV-A) causa menos daño al ADN, pero también produce una fluorescencia mucho más débil con el bromuro de etidio. Cuando se pueden seleccionar varias longitudes de onda en el transiluminador, se puede utilizar la longitud de onda más corta para capturar imágenes, mientras que la longitud de onda más larga debe utilizarse si es necesario trabajar en el gel durante un periodo de tiempo prolongado.
El aparato transiluminador también puede contener dispositivos de captura de imágenes, como una cámara digital o polaroid, que permiten tomar o imprimir una imagen del gel.
Para la electroforesis en gel de proteínas, las bandas pueden visualizarse con tinciones de Coomassie o de plata.
Procedimientos descendentes[editar]

Las bandas de ADN separadas suelen utilizarse para procedimientos posteriores, y una banda de ADN puede cortarse del gel en forma de rodaja, disolverse y purificarse. Sin embargo, los contaminantes pueden afectar a algunos procedimientos posteriores, como la PCR, y en algunos casos se prefiere la agarosa de bajo punto de fusión, ya que contiene menos sulfatos que pueden afectar a algunas reacciones enzimáticas. Los geles también pueden utilizarse para técnicas de blotting.
Tampones[editar]
En general, el tampón ideal debe tener una buena conductividad, producir menos calor y tener una larga vida útil.[31] Existen varios tampones utilizados para la electroforesis de agarosa; los más comunes para los ácidos nucleicos son Tris/Acetato/EDTA (TAE) y Tris/Borato/EDTA (TBE). Los tampones utilizados contienen EDTA para inactivar muchas nucleasas que requieren cationes divalentes para su funcionamiento. El borato del tampón TBE puede ser problemático, ya que el borato puede polimerizar y/o interactuar con dioles cis como los que se encuentran en el ARN. TAE tiene la capacidad tampón más baja, pero proporciona la mejor resolución para el ADN más grande. Esto significa un voltaje más bajo y más tiempo, pero un mejor producto.
Se han propuesto muchos otros tampones, por ejemplo, borato de litio (LB), histidina isoeléctrica, tampones de bienes de pK igualado, etc.; en la mayoría de los casos, la supuesta justificación es una menor corriente (menos calor) y/o movilidades iónicas igualadas, lo que conduce a una mayor vida útil del tampón. El tampón Tris-fosfato tiene una gran capacidad tampón, pero no puede utilizarse si el ADN extraído va a utilizarse en una reacción sensible al fosfato. LB es relativamente nuevo y es ineficaz para resolver fragmentos mayores de 5 kbp; sin embargo, con su baja conductividad, se podría utilizar un voltaje mucho más alto (hasta 35 V/cm), lo que significa un tiempo de análisis más corto para la electroforesis de rutina. En un gel de agarosa al 3% con un medio de conductividad extremadamente baja (1 mM de borato de litio) se pudo resolver una diferencia de tamaño de hasta un par de bases.[32]
Pueden utilizarse otros sistemas tampón en aplicaciones específicas, por ejemplo, tampones de ácido barbitúrico-barbitúrico sódico o Tris-barbitúrico para la electroforesis en gel de agarosa de proteínas, por ejemplo en la detección de la distribución anormal de proteínas.[33]
Aplicaciones[editar]
- Estimación del tamaño de las moléculas de ADN tras la digestión con enzimas de restricción, por ejemplo, en el mapeo de restricción del ADN clonado.
- Estimación de la concentración de ADN comparando la intensidad de la banda de ácido nucleico con la banda correspondiente del marcador de tamaño.[34]
- Análisis de productos de una reacción en cadena de la polimerasa (PCR), por ejemplo, en diagnóstico genético molecular o huella genética.
- Separación de fragmentos de ADN para su extracción y purificación.
- Separación del ADN genómico restringido antes de la transferencia Southern, o del ARN antes de la transferencia Northern.
- Separación de proteínas, por ejemplo, detección de anomalías proteínicas en química clínica.[35]
Los geles de agarosa se moldean y manipulan fácilmente en comparación con otras matrices y los ácidos nucleicos no se alteran químicamente durante la electroforesis. Las muestras también se recuperan fácilmente. Una vez finalizado el experimento, el gel resultante puede guardarse en una bolsa de plástico en el frigorífico.
La electroforesis se realiza en soluciones tampón para reducir los cambios de pH debidos al campo eléctrico, lo cual es importante porque la carga del ADN y el ARN depende del pH, pero si se realiza durante demasiado tiempo puede agotarse la capacidad tampón de la solución. Además, es posible que diferentes preparaciones de material genético no migren de forma coherente entre sí, por razones morfológicas o de otro tipo.
Véase también[editar]
Referencias[editar]
- ↑ Kryndushkin, Dmitry S.; Alexandrov, Ilya M.; Ter-Avanesyan, Michael D.; Kushnirov, Vitaly V. (2003-12). «Yeast [PSI+] Prion Aggregates Are Formed by Small Sup35 Polymers Fragmented by Hsp104». Journal of Biological Chemistry 278 (49): 49636-49643. ISSN 0021-9258. doi:10.1074/jbc.m307996200. Consultado el 28 de octubre de 2023.
- ↑ Sambrook J, Russel (2001). «Molecular Cloning: A Laboratory Manual 3rd Ed». Cold Spring Harbor Laboratory Press. Cold Spring Harbor, NY.
- ↑ Joseph Sambrook; David Russell. «Chapter 5, protocol 1». Molecular Cloning - A Laboratory Manual. ISBN 978-0-87969-577-4.
- ↑ a b c d Zimm BH, Levene SD (1992). «Problems and prospects in the theory of gel electrophoresis of DNA». Quarterly Reviews of Biophysics. PMID 1518924. doi:10.1017/s0033583500004662.
- ↑ Jean-Louis Viovy (2000). «Electrophoresis of DNA and other polyelectrolytes: Physical mechanisms». Reviews of Modern Physics: 813-872. doi:10.1103/RevModPhys.72.813.
- ↑ a b Philip Serwer (1983). «Agarose gels: Properties and use for electrophoresis». Electrophoresis: 375-382. doi:10.1002/elps.1150040602.
- ↑ Joseph Sambrook; David Russell. «Chapter 5, protocol 1». Molecular Cloning - A Laboratory Manual. Vol. 1: 5.2-5.3. ISBN 978-0-87969-577-4.
- ↑ «Appendix B: Agarose Physical Chemistry». Lonza Group. 2022.
- ↑ Joseph Sambrook; David Russell. «Chapter 5, protocol 1». Molecular Cloning - A Laboratory Manual. Vol. 1: 5.7. ISBN 978-0-87969-577-4.
- ↑ Keren, David (26 de septiembre de 2003). Protein Electrophoresis in Clinical Diagnosis (en inglés). CRC Press. ISBN 978-0-340-81213-6. Consultado el 28 de octubre de 2023.
- ↑ G. Lucotte; F. Baneyx (1993). «Introduction to Molecular Cloning Techniques». Wiley-Blackwell. ISBN 978-0471188490.
- ↑ a b c d e f Lee PY, Costumbrado J. , Hsu CY. , Kim YH. (2012). «"Agarose gel electrophoresis for the separation of DNA fragments». Journal of Visualized Experiments. PMID 22546956. doi:10.3791/3923.
- ↑ Sinden, Richard R. (10 de noviembre de 1994). DNA Structure and Function (en inglés). Gulf Professional Publishing. ISBN 978-0-12-645750-6. Consultado el 28 de octubre de 2023.
- ↑ a b Joseph Sambrook; David Russell. «Chapter 5, protocol 1». Molecular Cloning - A Laboratory Manual. Vol. 1: 5.5-5.6. ISBN 978-0-87969-577-4.
- ↑ Aaij C, Borst P (1972). «The gel electrophoresis of DNA». Biochimica et Biophysica Acta (BBA) - Nucleic Acids and Protein Synthesis: 192-200. PMID 5063906. doi:10.1016/0005-2787(72)90426-1.
- ↑ Internet Archive (1995). Biochemistry. J. Wiley & Sons. ISBN 978-0-471-58651-7. Consultado el 28 de octubre de 2023.
- ↑ Blasiak J, Trzeciak A, Malecka-Panas E, Drzewoski J, Wojewódzka M. (2000). «In vitro genotoxicity of ethanol and acetaldehyde in human lymphocytes and the gastrointestinal tract mucosa cells». Toxicology in Vitro: 287-95. PMID 10906435. doi:10.1016/S0887-2333(00)00022-9.
- ↑ Lu, Y.; Morimoto, K. (13 de marzo de 2009). «Is habitual alcohol drinking associated with reduced electrophoretic DNA migration in peripheral blood leukocytes from ALDH2-deficient male Japanese?». Mutagenesis 24 (4): 303-308. ISSN 0267-8357. doi:10.1093/mutage/gep008. Consultado el 29 de octubre de 2023.
- ↑ G. Lucotte; F. Baneyx (1993). «Introduction to Molecular Cloning Techniques.». Wiley-Blackwell. ISBN 978-0471188490.
- ↑ Internet Archive, R. W.; Primrose, S. B. (1994). Principles of gene manipulation : an introduction to genetic engineering. Oxford : Boston : Blackwell Scientific. ISBN 978-0-632-03712-4. Consultado el 29 de octubre de 2023.
- ↑ Tian, Wei-Cheng; Finehout, Erin (2 de marzo de 2009). Microfluidics for Biological Applications (en inglés). Springer Science & Business Media. ISBN 978-0-387-09480-9. Consultado el 29 de octubre de 2023.
- ↑ Smith SB, Aldridge PK, Callis JB. (1989). «Observation of individual DNA molecules undergoing gel electrophoresis». Science: 203-6. PMID 2911733. doi:10.1126/science.2911733.
- ↑ Schwartz DC, Koval M. (1989). «Conformational dynamics of individual DNA molecules during gel electrophoresis». Nature: 520-2. PMID 2927511. doi:10.1038/338520a0.
- ↑ Magdeldin, Sameh (2012). «Gel Electrophoresis». InTech.
- ↑ «Agarose gel electrophoresis (basic method)». www.methodbook.net. Consultado el 29 de octubre de 2023.
- ↑ Fotadar U, Shapiro LE, Surks MI. (1991). «Simultaneous use of standard and low-melting agarose for the separation and isolation of DNA by electrophoresis». BioTechniques. PMID 2059440.
- ↑ David Freifelder (1982). «Physical Biochemistry: Applications to Biochemistry and Molecular Biology». WH Freeman: 292-293. ISBN 978-0716714446.
- ↑ «Section III: Loading and Running DNA in Agarose Gels». Lonza Group. 2022.
- ↑ «DNA revealed». National Centre for Biotechnology education.
- ↑ Gründemann, Dirk; Schömig, Edgar (1996-11). «Protection of DNA During Preparative Agarose Gel Electrophoresis Against Damage Induced by Ultraviolet Light». BioTechniques 21 (5): 898-903. ISSN 0736-6205. doi:10.2144/96215rr02. Consultado el 29 de octubre de 2023.
- ↑ Sameh Magdeldin, ed. (2012). «Gel electrophoresis – Principles and Basics». InTech. ISBN 978-953-51-0458-2.
- ↑ Brody JR, Kern SE. (2004). «History and principles of conductive media for standard DNA electrophoresis». Analytical Biochemistry. PMID 15351274. doi:10.1016/j.ab.2004.05.054.
- ↑ Jeppsson JO, Laurell CB, Franzén B. «Agarose gel electrophoresis». academic.oup.com. Consultado el 29 de octubre de 2023.
- ↑ «RNA and DNA quantification methods | INTEGRA». www.integra-biosciences.com (en inglés estadounidense). 24 de junio de 2021. Consultado el 29 de octubre de 2023.
- ↑ Giot, Jean-Francois (2010). «Agarose gel electrophoresis: Application in Clinical Chemistry». Journal of Medical Biochemistry. doi:10.2478/v10011-009-0033-8.
