Anexo:Isótopos de yodo

Hay 37 isótopos conocidos de yodo (53I) desde 108I a 144I; todos sufren decaimiento radiactivo excepto 127I, que es estable. El yodo es, por lo tanto, un elemento monoisotópico.
Su isótopo radiactivo de mayor vida media, 129I, tiene un periodo de semidesintegración de 15,7 millones de años, que es demasiado corto para que exista como un nucleido primordial. Las fuentes cosmogénicas de 129I producen cantidades muy pequeñas de ella que son demasiado pequeñas para afectar las mediciones del peso atómico; por lo tanto, el yodo es también un elemento mononucleico -sólo se encuentra en la naturaleza como un único nucleido. La mayor parte de la radiaoctividad derivada de la Tierra es producida por el hombre, un subproducto no deseado debido a pruebas nucleares y accidentes de fisión nuclear.
Todos los demás radioisótopos de yodo tienen periodos de semidesintegración menores de 60 días, y cuatro de estos se usan como trazadores y agentes terapéuticos en medicina. Estos son 123I, 124I, 125I y 131I. Toda la producción industrial de isótopos radioactivos de yodo implica estos cuatro radionucleidos útiles.
El isótopo 135I tiene un periodo de semidesintegración menor de siete horas, y es demasiado corto como para ser utilizado en biología. La producción in situ de este isótopo es importante en el control de los reactores nucleares, ya que se descompone en 135Xe, el absorbente de neutrones más potente conocido, y el nucleido responsable del fenómeno de los llamados fosos de yodo.
Además de la producción comercial, 131I (periodo de semidesintegración de 8 días) es uno de los productos de fisión radioactivos comunes de la fisión nuclear, y por lo tanto se produce inadvertidamente en cantidades muy grandes dentro de los reactores nucleares. Debido a su volatilidad, su corta vida media y su alta abundancia en los productos de fisión, el 131I (junto con el isótopo 132I) es responsable de la mayor parte de la contaminación radioactiva durante la primera semana después de que se produzca una contaminación ambiental accidental debido a los desechos radioactivos de una central nuclear.
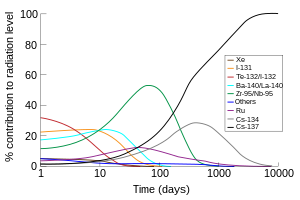
Radioisótopos notables
[editar]Los radioisótopos de yodo se denominan yodo radioactivo. Existen docenas, pero una media docena son las más notables en ciencias aplicadas como las ciencias naturales y la energía nuclear, como se detalla a continuación. Las menciones de yodo radioactivo en los contextos de la salud se refieren con más frecuencia al 131I que a otros isótopos.
El yodo 129 como radionucleido extinto
[editar]Se ha demostrado que los excesos de 129Xe estable en meteoritos resultan de la desintegración del 129I producido por supernovas recientes que crearon el polvo y el gas de los que se formó el sistema solar. Este isótopo ha decaído durante mucho tiempo y, por lo tanto, se conoce como "extinto". Históricamente, 129I fue el primer radionucleido extinto que se identificó como presente en el Sistema Solar temprano. Su descomposición es la base del esquema de datación radiométrica del yodo-xenón, que cubre los primeros 85 millones de años de evolución del Sistema Solar.
Yodo 129 como marcador de larga vida para la contaminación por fisión nuclear
[editar]El 129I (periodo de semidesintegración de 15,7 millones de años) es un producto de la espalación de rayos cósmicos en varios isótopos de xenón en la atmósfera, en la interacción de los rayos cósmicos con 130Te y también en la fisión de uranio y plutonio. Los procesos nucleares artificiales, en particular el reprocesamiento del combustible nuclear y las pruebas de las armas nucleares atmosféricas, han inundado la señal natural para este isótopo. Sin embargo, ahora sirve como trazador de aguas subterráneas y como indicador de la dispersión de desechos nucleares en el medio ambiente natural. De manera similar, 129I se utilizó en estudios de aguas pluviales para rastrear los productos de fisión después del accidente de Chernobyl.
En algunos aspectos, 129I es similar a 36Cl. Es un halógeno soluble, bastante no reactivo, existe principalmente como anión no sorbente, y es producido por reacciones cosmogénicas, termonucleares e in situ. En los estudios hidrológicos, las concentraciones de 129I se informan generalmente como la proporción de 129I a I total. Como es el caso con 36Cl/Cl, las proporciones de 129I/I en la naturaleza son bastante pequeñas, 10-14 a 10-10. 129I difiere de 36Cl en que su periodo de semidesintegración es más largo (15,7 vs 0,301 millones de años), es altamente biofílica, y se presenta en múltiples formas iónicas (comúnmente, I- e IO3-), que tienen diferentes comportamientos químicos. Esto hace bastante fácil para el 129I entrar en la biosfera a medida que se incorpora a la vegetación, el suelo, la leche, el tejido animal, etc.
Radioyodos I-123, I-124, I-125 e I-131 en medicina y biología
[editar]De los muchos isótopos de yodo, sólo dos se usan típicamente en un entorno médico: 123I y 131I. Dado que 131I tiene un modo de desintegración beta y gamma, puede utilizarse para la radioterapia o para la obtención de imágenes. 123I, que no tiene actividad beta, es más adecuado para la imagen de medicina nuclear rutinaria de tiroides y otros procesos médicos y menos dañina internamente al paciente. Hay algunas situaciones en las que el 124I y el 125I se utilizan en la medicina, también.[2]
Debido a la captación preferente de yodo por la tiroides, el yodo radioactivo se utiliza ampliamente en la formación de imágenes y, en el caso de la 131I, pueden causar la destrucción de los tejidos tiroideos disfuncionales. Otros tipos de tejido absorben selectivamente ciertos agentes radiofarmacéuticos que atacan y destruyen los tejidos que contienen 131I (tales como MIBG). El 125I es el único otro radioisótopo de yodo utilizado en radioterapia, pero solo como una cápsula implantada en la braquiterapia, donde el isótopo nunca tiene la oportunidad de ser liberado para la interacción química con los tejidos del cuerpo.
Yodo 131
[editar]El 131I es un isótopo emisor beta con un periodo de semidesintegración de ocho días y una radiación beta de 190 keV media y 606 keV energía máxima, que penetra de 0,6 a 2,0 mm desde el sitio de absorción. Esta radiación beta puede usarse para la destrucción de nódulos tiroideos o tejido tiroideo hiperfuncionante y para la eliminación del tejido tiroideo restante después de la cirugía para el tratamiento de la enfermedad de Graves-Basedow. El propósito de esta terapia, que fue explorada por primera vez por el Dr. Saul Hertz en 1941,[3] es destruir el tejido tiroideo que no se pudo extirpar quirúrgicamente. En este procedimiento, 131I se administra intravenosa u oralmente después de un escáner de diagnóstico. Este procedimiento también se puede utilizar, con dosis más altas de radio-yodo, para tratar a pacientes con cáncer tiroideo.
El 131I se recoge en el tejido tiroideo y se concentra allí. Las partículas beta emitidas por el radioisótopo destruyen el tejido tiroideo asociado con poco daño a los tejidos circundantes (más de 2,0 mm de los tejidos que absorben el yodo). Debido a una destrucción similar, 131I es el radioisótopo de yodo utilizado en otros productos radiofarmacéuticos etiquetados con yodo soluble en agua (tales como MIBG) usados terapéuticamente para destruir tejidos.
La radiación beta de alta energía (hasta 606 keV) de 131I hace que sea el más carcinógeno de los isótopos de yodo.Se cree que causa la mayoría de los cánceres de tiroides en exceso vistos después de la contaminación por fisión nuclear (tales como fallas de bombas o accidentes graves de reactores nucleares como el accidente de Chernobyl). Sin embargo, estos efectos epidemiológicos se observan principalmente en niños, y el tratamiento de adultos y niños con tratamiento terapéutico 131I , y la epidemiología de los adultos expuestos a dosis bajas 131I no ha demostrado carcinogenicidad.[4]
Yodo 123 y yodo 125
[editar]Los isótopos gamma-emisores 123I (periodo de semidesintegración de 13 horas) y, menos comúnmente, 125I (periodo de semidesintegración de 59 días) son usados como trazadores de imágenes nucleares para evaluar las características anatómicas y fisiológicas de la tiroides. Los resultados anormales pueden ser causados por trastornos como la enfermedad de Graves-Basedow o la tiroiditis de Hashimoto. Ambos isótopos se desintegran por captura electrónica (CE) a los correspondientes nucleidos de telurio, pero en ninguno de los dos casos se trata de los nucleidos metaestables 123mTe y 125mTe (que son de mayor energía y no son producidos a partir del yodo radioactivo). En cambio, los nucleidos de telurio excitados decaen de inmediato (el periodo de semidesintegración es demasiado corto como para detectar). Siguiendo una CE, el 123mTe excitado de 123mI emite un electrón de 127 keV de conversión interna (no un rayo beta) alrededor del 13% del tiempo, aun así esto produce poco daño celular debido a la corto periodo de semidesintegración del nucleido y la fracción relativamente pequeña de tales eventos. En el resto de los casos, se emite un rayo gamma de 159 keV, adecuado para imágenes gamma.
El 125Te excitado de la CE que decae en 125I emite un electrón de conversión interna de energía mucho más baja (35,5 keV), que produce relativamente poco daño debido a su baja energía, aunque su emisión es más común. La emisión de energía gamma a partir de la desintegración 125I/125Te es poco adecuado para realizar imágenes. Aun así, este isótopo es necesario en las pruebas que requieren varios días de imágenes, por ejemplo, imágenes de barrido de fibrinógeno para detectar coágulos sanguíneos.
Ambos 123I e 125I emiten electrones Auger de baja energía después de su descomposición, pero estos no causan daño grave (rupturas de ADN de doble cadena) en las células, a menos que el nucleido se incorpore en un medicamento que se acumule en el núcleo (esto nunca sucede en la medicina clínica, pero se ha visto en modelos de animales experimentales).[5]
El 125Itambién es comúnmente utilizado por los oncólogos en braquiterapia de dosis baja en el tratamiento del cáncer en sitios distintos de la tiroides, especialmente en el cáncer de próstata. Cuando 125I se utiliza terapéuticamente, se encapsula en semillas de titanio y se implanta en la zona del tumor, donde permanece. La baja energía del espectro gamma en este caso limita el daño de radiación a los tejidos lejos de la cápsula implantada. El 125I, debido a su largo periodo de semidesintegración y un espectro gamma menos penetrante. También se prefiere a menudo para pruebas de laboratorio que se basan en el yodo como un trazador que es contado por un contador gamma, tal como en el radioinmunoensayo.
La mayoría de imágenes médicas con yodo se hace con una cámara gamma estándar. Sin embargo, los rayos gamma de 123I y 131I también puede ser visto por tomografía computarizada de emisión monofotónica (SPECT).
Yodo 124
[editar]El 124I es un isótopo rico en protones de yodo con un periodo de semidesintegración de 4,18 días. Sus modos de desintegración son: 74,4% de captura electrónica, 25,6% de emisión de positrones. Se desintegra hasta 124Te. El 124I puede fabricarse mediante reacciones nucleares numéricas a través de un ciclotrón. El material de partida más común usado es 124Te.
El 124I como sal de yoduro puede usarse para la imagen directa de la tiroides usando la tomografía por emisión de positrones (PET).[6] El 124I también puede utilizarse como radiotrazador de PET con un periodo de semidesintegración útil más largo en comparación con el flúor-18.[7] En este uso, el nucleido está unido químicamente a un producto farmacéutico para formar un radiofármaco emisor de positrones, que luego es inyectado en el cuerpo, donde es fotografiado por un escáner PET.
Yodo-135 y control de reactores nucleares
[editar]El 135I es un isótopo de yodo con un periodo de semidesintegración de 6,6 horas. Es un isótopo importante desde el punto de vista de la física de los reactores nucleares. Se produce en cantidades relativamente grandes como un producto de fisión nuclear, y se descompone en 135Xe, que es un veneno nuclear con una sección transversal de neutrones térmicos muy grande, que es una causa de múltiples complicaciones en el control de reactores nucleares. El proceso de acumulación de 135Xe a partir del 135I acumulado puede impedir temporalmente que se reinicie un reactor apagado. Esto se conoce como envenenamiento por xenón.
Yodo-128 y otros isótopos
[editar]Los isótopos producidos por fisión de yodo no discutidos anteriormente (128I, 130I, 132I y 133I) tienen un periodo de semidesintegración de un par de horas o minutos, haciéndolos casi inútiles en otras áreas aplicables. Los mencionados son ricos en neutrones y por lo tanto pasan a la desintegración beta a sus homólogos de xenón. El 128I (25 min de periodo de semidesintegración) puede decaer al 128Te por captura de electrones, o al 128Xe por desintegraciónbeta. Tiene una radioactividad específica de 2,177 x 106 TBq/g.
El yoduro no radiactivo (I-127) como protección contra la absorción no deseada de yodo radioactivo por la tiroides
[editar]Coloquialmente, los materiales radioactivos pueden ser descritos como "calientes", y los materiales no radiactivos pueden ser descritos como "fríos". Hay casos en que el yoduro frío se administra a las personas con el fin de evitar la absorción de yoduro caliente por la glándula tiroides. Por ejemplo, el bloqueo de la absorción de yodo de tiroides con yoduro de potasio se utiliza en la gammagrafía de medicina nuclear y la terapia con algunos compuestos radioyodados que no están dirigidos a la tiroides, como el iobenguano (MIBG), que se utiliza para la imagen o el tratamiento tumores de tejido neural o fibrinógeno yodado, que se utiliza en exploraciones de fibrinógeno para investigar la coagulación. Estos compuestos contienen yodo, pero no en forma de yoduro. Sin embargo, dado que pueden ser metabolizados o descomponerse en yoduro radiactivo, es común administrar yoduro de potasio no radiactivo para asegurar que los metabolitos de estos radiofármacos no sean secuestrados por la glándula tiroides y inadvertidamente administrar una dosis radiológica a ese tejido.
El yoduro de potasio se ha distribuido a poblaciones expuestas a accidentes de fisión nuclear como el accidente de Chernobyl. La solución de yoduro SSKI, una solución saturada de yoduro de potasio (K) en agua, se ha utilizado para bloquear la absorción del yodo radioactivo (no tiene ningún efecto sobre otros radioisótopos de la fisión). Los comprimidos que contienen yoduro de potasio también son fabricados y almacenados en centros de desastre central por algunos gobiernos para este propósito. En teoría, muchos efectos perjudiciales del cáncer nuclear tardío pueden ser prevenidos de esta manera, ya que un exceso de cáncer de tiroides, presumiblemente debido a la absorción de yodo radioactivo, es el único efecto probado de contaminación por radioisótopos después de un accidente de fisión o de contaminación por precipitaciones de una bomba atómica (la radiación inmediata de la bomba también causa otros cánceres, como leucemias, directamente). Tomar grandes cantidades de yoduro satura los receptores tiroideos e impide la absorción de la mayor parte del 131I radiactivo que puede estar presente por exposición al producto de fisión (aunque no protege de otros radioisótopos ni de ninguna otra forma de radiación directa). El efecto protector de yoduro de potasio dura aproximadamente 24 horas, por lo que debe ser dosificado diariamente hasta que ya no exista un riesgo de exposición significativa a radioyodo.[8][9] El yodo-131 (el contaminante radioactivo más común en las precipitaciones) también se desintegra relativamente más rápido, con un periodo de semideintegración de ocho días, por lo que el 99,95% del yodo original desaparece al cabo de tres meses.
Tabla de isótopos
[editar]| Símbolo del nucleido |
Z(p) | N(n) | Masa isotópica (u) |
Vida media | Método(s) de decaimiento[10][n 1] |
daughter isotope(s)[n 2] |
Espín nuclear |
Composición isotópica representativa (fracción molar) |
Rango de variación natural (fracción molar) |
|---|---|---|---|---|---|---|---|---|---|
| Energía de excitación | |||||||||
| 108I | 53 | 55 | 107.94348(39)# | 36(6) ms | α (90%) | 104Sb | (1)# | ||
| β+ (9%) | 108Te | ||||||||
| p (1%) | 107Te | ||||||||
| 109I | 53 | 56 | 108.93815(11) | 103(5) µs | p (99.5%) | 108Te | (5/2+) | ||
| α (.5%) | 105Sb | ||||||||
| 110I | 53 | 57 | 109.93524(33)# | 650(20) ms | β+ (83%) | 110Te | 1+# | ||
| α (17%) | 106Sb | ||||||||
| β+, p (11%) | 109Sb | ||||||||
| β+, α (1.09%) | 106Sn | ||||||||
| 111I | 53 | 58 | 110.93028(32)# | 2.5(2) s | β+ (99.92%) | 111Te | (5/2+)# | ||
| α (.088%) | 107Sb | ||||||||
| 112I | 53 | 59 | 111.92797(23)# | 3.42(11) s | β+ (99.01%) | 112Te | |||
| β+, p (.88%) | 111Sb | ||||||||
| β+, α (.104%) | 108Sn | ||||||||
| α (.0012%) | 108Sb | ||||||||
| 113I | 53 | 60 | 112.92364(6) | 6.6(2) s | β+ (100%) | 113Te | 5/2+# | ||
| α (3.3×10−7%) | 109Sb | ||||||||
| β+, α | 109Sn | ||||||||
| 114I | 53 | 61 | 113.92185(32)# | 2.1(2) s | β+ | 114Te | 1+ | ||
| β+, p (raro) | 113Sb | ||||||||
| 114mI | 265.9(5) keV | 6.2(5) s | β+ (91%) | 114Te | (7) | ||||
| TI (9%) | 114I | ||||||||
| 115I | 53 | 62 | 114.91805(3) | 1.3(2) min | β+ | 115Te | (5/2+)# | ||
| 116I | 53 | 63 | 115.91681(10) | 2.91(15) s | β+ | 116Te | 1+ | ||
| 116mI | 400(50)# keV | 3.27(16) µs | (7−) | ||||||
| 117I | 53 | 64 | 116.91365(3) | 2.22(4) min | β+ | 117Te | (5/2)+ | ||
| 118I | 53 | 65 | 117.913074(21) | 13.7(5) min | β+ | 118Te | 2− | ||
| 118mI | 190.1(10) keV | 8.5(5) min | β+ | 118Te | (7−) | ||||
| TI (raro) | 118I | ||||||||
| 119I | 53 | 66 | 118.91007(3) | 19.1(4) min | β+ | 119Te | 5/2+ | ||
| 120I | 53 | 67 | 119.910048(19) | 81.6(2) min | β+ | 120Te | 2− | ||
| 120m1I | 72.61(9) keV | 228(15) ns | (1+,2+,3+) | ||||||
| 120m2I | 320(15) keV | 53(4) min | β+ | 120Te | (7−) | ||||
| 121I | 53 | 68 | 120.907367(11) | 2.12(1) h | β+ | 121Te | 5/2+ | ||
| 121mI | 2376.9(4) keV | 9.0(15) µs | |||||||
| 122I | 53 | 69 | 121.907589(6) | 3.63(6) min | β+ | 122Te | 1+ | ||
| 123I[n 3] | 53 | 70 | 122.905589(4) | 13.2235(19) h | CE | 123Te | 5/2+ | ||
| 124I[n 3] | 53 | 71 | 123.9062099(25) | 4.1760(3) d | β+ | 124Te | 2− | ||
| 125I[n 3] | 53 | 72 | 124.9046302(16) | 59.400(10) d | CE | 125Te | 5/2+ | ||
| 126I | 53 | 73 | 125.905624(4) | 12.93(5) d | β+ (56.3%) | 126Te | 2− | ||
| β− (43.7%) | 126Xe | ||||||||
| 127I[n 4] | 53 | 74 | 126.904473(4) | Estable[n 5] | 5/2+ | 1.0000 | |||
| 128I | 53 | 75 | 127.905809(4) | 24.99(2) min | β− (93.1%) | 128Xe | 1+ | ||
| β+ (6.9%) | 128Te | ||||||||
| 128m1I | 137.850(4) keV | 845(20) ns | 4− | ||||||
| 128m2I | 167.367(5) keV | 175(15) ns | (6)− | ||||||
| 129I[n 4][n 6] | 53 | 76 | 128.904988(3) | 1.57(4)×107 y | β− | 129Xe | 7/2+ | Trace[n 7] | |
| 130I | 53 | 77 | 129.906674(3) | 12.36(1) h | β− | 130Xe | 5+ | ||
| 130m1I | 39.9525(13) keV | 8.84(6) min | TI (84%) | 130I | 2+ | ||||
| β− (16%) | 130Xe | ||||||||
| 130m2I | 69.5865(7) keV | 133(7) ns | (6)− | ||||||
| 130m3I | 82.3960(19) keV | 315(15) ns | - | ||||||
| 130m4I | 85.1099(10) keV | 254(4) ns | (6)− | ||||||
| 131I[n 4][n 3] | 53 | 78 | 130.9061246(12) | 8.02070(11) d | β− | 131Xe | 7/2+ | ||
| 132I | 53 | 79 | 131.907997(6) | 2.295(13) h | β− | 132Xe | 4+ | ||
| 132mI | 104(12) keV | 1.387(15) h | TI (86%) | 132I | (8−) | ||||
| β− (14%) | 132Xe | ||||||||
| 133I | 53 | 80 | 132.907797(5) | 20.8(1) h | β− | 133Xe | 7/2+ | ||
| 133m1I | 1634.174(17) keV | 9(2) s | TI | 133I | (19/2−) | ||||
| 133m2I | 1729.160(17) keV | ~170 ns | (15/2−) | ||||||
| 134I | 53 | 81 | 133.909744(9) | 52.5(2) min | β− | 134Xe | (4)+ | ||
| 134mI | 316.49(22) keV | 3.52(4) min | TI (97.7%) | 134I | (8)− | ||||
| β− (2.3%) | 134Xe | ||||||||
| 135I[n 8] | 53 | 82 | 134.910048(8) | 6.57(2) h | β− | 135Xe | 7/2+ | ||
| 136I | 53 | 83 | 135.91465(5) | 83.4(10) s | β− | 136Xe | (1−) | ||
| 136mI | 650(120) keV | 46.9(10) s | β− | 136Xe | (6−) | ||||
| 137I | 53 | 84 | 136.917871(30) | 24.13(12) s | β− (92.86%) | 137Xe | (7/2+) | ||
| β−, n (7.14%) | 136Xe | ||||||||
| 138I | 53 | 85 | 137.92235(9) | 6.23(3) s | β− (94.54%) | 138Xe | (2−) | ||
| β−, n (5.46%) | 137Xe | ||||||||
| 139I | 53 | 86 | 138.92610(3) | 2.282(10) s | β− (90%) | 139Xe | 7/2+# | ||
| β−, n (10%) | 138Xe | ||||||||
| 140I | 53 | 87 | 139.93100(21)# | 860(40) ms | β− (90.7%) | 140Xe | (3)(−#) | ||
| β−, n (9.3%) | 139Xe | ||||||||
| 141I | 53 | 88 | 140.93503(21)# | 430(20) ms | β− (78%) | 141Xe | 7/2+# | ||
| β−, n (22%) | 140Xe | ||||||||
| 142I | 53 | 89 | 141.94018(43)# | ~200 ms | β− (75%) | 142Xe | 2−# | ||
| β−, n (25%) | 141Xe | ||||||||
| 143I | 53 | 90 | 142.94456(43)# | 100# ms [> 300 ns] | β− | 143Xe | 7/2+# | ||
| 144I | 53 | 91 | 143.94999(54)# | 50# ms [> 300 ns] | β− | 144Xe | 1−# | ||
- ↑ Abreviaciones:
CE: Captura electrónica
TI: Transición isomérica - ↑ Negrilla para los isótopos estables, negrilla y cursiva para los isótopos con vidas media mayores a la edad del universo
- ↑ a b c d Tiene usos médicos
- ↑ a b c Productos de la fisión nuclear
- ↑ Se cree que puede realizar fisión espontánea
- ↑ Puede utilizarse para fechar ciertos eventos tempranos en la historia del Sistema Solar y para datar las aguas subterráneas
- ↑ Nucleido cosmogénico, también encontrado en la contaminación nuclear
- ↑ Producido como producto de descomposición de 135Te en reactores nucleares, que a su vez decae 135Xe, el cual, si se permite su acumulación, puede cerrar los reactores debido al fenómeno del yodo
Notas
[editar]- Los valores marcados con # no se derivan puramente de los datos experimentales, sino de las tendencias sistemáticas. Los espines de asignación débiles se incluyen entre paréntesis.
- Las incertidumbres se dan en forma concisa entre paréntesis después de los últimos dígitos. Los valores de incertidumbre indican una desviación estándar, excepto la composición isotópica y el peso atómico atómico estándar del IUPAC, que utilizan incertidumbres expandidas.
Referencias
[editar]- ↑ «Nuclear Data Evaluation Lab». Archivado desde el original el 21 de enero de 2007. Consultado el 13 de mayo de 2009.
- ↑ Augustine George; James T Lane; Arlen D Meyers (17 de enero de 2013). Radioactive Iodine Uptake Testing. Medscape.
- ↑ Hertz, Barbara; Schuleller, Kristin (2010). «Saul Hertz, MD (1905 - 1950) A Pioneer in the Use of Radioactive Iodine». Endocrine Practice 16 (4): 713-715.
- ↑ Robbins, Jacob; Schneider, Arthur B. (2000). «Thyroid cancer following exposure to radioactive iodine». Reviews in Endocrine and Metabolic Disorders 1 (3): 197-203. ISSN 1389-9155. PMID 11705004. doi:10.1023/A:1010031115233.
- ↑ V. R. Narra (1992). «Radiotoxicity of Some Iodine-123, Iodine-125, and Iodine-131-Labeled Compounds in Mouse Testes: Implications for Radiopharmaceutical Design». Journal of Nuclear Medicine 33 (12): 2196.
- ↑ E. Rault (2007). «Comparison of Image Quality of Different Iodine Isotopes (I-123, I-124, and I-131)». Cancer Biotherapy & Radiopharmaceuticals 22 (3): 423-430. PMID 17651050. doi:10.1089/cbr.2006.323.
- ↑ BV Cyclotron VU, Amsterdam, 2016, Information on Iodine-124 for PET
- ↑ «Frequently Asked Questions on Potassium Iodide». Food and Drug Administration. Consultado el 6 de junio de 2009.
- ↑ «Potassium Iodide as a Thyroid Blocking Agent in Radiation Emergencies». Federal Register. Food and Drug Administration. Consultado el 6 de junio de 2009.
- ↑ «Universal Nuclide Chart». nucleonica. (requiere registro).
- Masas de isótopos de:
- G. Audi; A. H. Wapstra; C. Thibault; J. Blachot; O. Bersillon (2003). «The NUBASE evaluation of nuclear and decay properties». Nuclear Physics A 729: 3-128. Bibcode:2003NuPhA.729....3A. doi:10.1016/j.nuclphysa.2003.11.001.
- Composición isotópica y masas atómicas estándar de:
- J. R. de Laeter; J. K. Böhlke; P. De Bièvre; H. Hidaka; H. S. Peiser; K. J. R. Rosman; P. D. P. Taylor (2003). «Atomic weights of the elements. Review 2000 (IUPAC Technical Report)». Pure and Applied Chemistry 75 (6): 683-800. doi:10.1351/pac200375060683.
- M. E. Wieser (2006). «Atomic weights of the elements 2005 (IUPAC Technical Report)». Pure and Applied Chemistry 78 (11): 2051-2066. doi:10.1351/pac200678112051. Resumen divulgativo.
- Vida media, Espín, y datos de isómeros seleccionados de las siguientes fuentes.
- G. Audi; A. H. Wapstra; C. Thibault; J. Blachot; O. Bersillon (2003). «The NUBASE evaluation of nuclear and decay properties». Nuclear Physics A 729: 3-128. Bibcode:2003NuPhA.729....3A. doi:10.1016/j.nuclphysa.2003.11.001.
- National Nuclear Data Center. «NuDat 2.1 database». Brookhaven National Laboratory. Consultado el September 2005.
- N. E. Holden (2004). «Table of the Isotopes». En D. R. Lide, ed. CRC Handbook of Chemistry and Physics (85th edición). CRC Press. Section 11. ISBN 978-0-8493-0485-9.
