Amaurosis congénita de Leber
| Amaurosis congénita de Leber LCA1 | ||
|---|---|---|
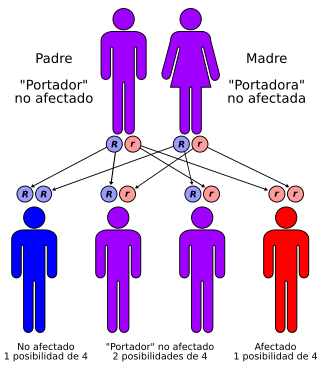 Amaurosis congénita de Leber se transmite con un patrón autosómico recesivo | ||
| Especialidad | oftalmología | |
| Causas | Genética, autosómica recesiva | |
La amaurosis congénita de Leber (LCA) es una enfermedad de la retina (retinopatía) de origen genético, caracterizada por un grave déficit visual en los niños desde los primeros meses de vida. Se produce una pérdida grave tanto de bastones como de conos en toda la retina desde el nacimiento. Supone entre el 10-18 % de los casos de ceguera congénita y su incidencia es de 1 de cada 35 000 nacidos vivos. No debe confundirse con la Neuropatía óptica hereditaria de Leber que es otra enfermedad diferente, aunque ambas fueron descritas por el oftalmólogo Theodor Leber en el siglo XIX.
Características[editar]
Se caracteriza por su gran heterogeneidad tanto clínica como genética, aunque su patrón de herencia es generalmente autosómico recesivo, se han descrito casos con herencia autosómica dominante. Contando con el primer tipo definido genéticamente, LCA1,[1] la clasificación genética OMIM reconoce actualmente 18 tipos de LCA:
| Tipo | OMIM | Gen | Locus |
| LCA1 | 204000 | GUCY2D,[2] | 17p13.1 |
| LCA2 | 204100 | RPE65[3] | 1p31.3-p31.2 |
| LCA3 | 609868 | SPATA7 | 14q31.3 |
| LCA4 | 604393 | AIPL1[4][5] | 17p13.2 |
| LCA5 | 604537 | LCA5[6] | 6q14.1 |
| LCA6 | 605446 | RPGRIP1 | 14q11.2 |
| LCA7 | 602225 | CRX[7] | 19q13.3 |
| LCA8 | 604210 | CRB1[7] | 1q31-q32.1 |
| LCA9 | 608553 | NMNAT1[8][9][10][11] | 1p36.22 |
| LCA10 | 610142 | CEP290 | 12q21.32 |
| LCA11 | 146690 | IMPDH1 | 7q32.1 |
| LCA12 | 180040 | RD3 | 7q32.1 |
| LCA13 | 608830 | RDH12 | 1q32.3 |
| LCA14 | 604863 | LRAT | 14q24.1 |
| LCA15 | 602280 | TULP1 | 4q31 |
| LCA16 | 603208 | KCNJ13 | 2q37 |
| LCA17 | 601147 | GDF6 | 8q22 |
| LCA18 | 179605 | PRPH2 | 6p21 |
Todos estos genes se expresan preferentemente en la retina o el epitelio pigmentario de la retina.
Tratamiento[editar]
Científicos de la Universidad de Pensilvania[12] descubrieron que inoculando un virus modificado detrás de la retina de niños que padecían amaurosis de Leber de tipo LCA 2, lograban mejorar la visión incorporando el gen faltante RPE65 a través de un adenovirus que actúa como vector.[13] En 2018 la FDA de Estados Unidos aprobó el empleo del medicamento voretigene neparvovec para tratar la enfermedad.[14][15][16]
Referencias[editar]
- ↑ OMIM 204000
- ↑ Perrault I; Rozet JM; Calvas P; etal (diciembre de 1996). «Retinal-specific guanylate cyclase gene mutations in Leber's congenital amaurosis». Nat. Genet. 14 (4): 461-4. PMID 8944027. doi:10.1038/ng1296-461.
- ↑ Marlhens F; Bareil C; Griffoin JM; etal (octubre de 1997). «Mutations in RPE65 cause Leber's congenital amaurosis». Nat. Genet. 17 (2): 139-41. PMID 9326927. doi:10.1038/ng1097-139.
- ↑ Yzer S; Leroy BP; De Baere E; etal (marzo de 2006). «Microarray-based mutation detection and phenotypic characterization of patients with Leber congenital amaurosis». Invest. Ophthalmol. Vis. Sci. 47 (3): 1167-76. PMID 16505055. doi:10.1167/iovs.05-0848.
- ↑ «Inherited child blindness probed». BBC News. 19 de septiembre de 2005. Consultado el 21 de septiembre de 2007.
- ↑ Dharmaraj S; etal (enero de 2000). «A Novel Locus for Leber Congenital Amaurosis Maps to Chromosome 6q». The American Journal of Human Genetics 66 (1): 319-326. PMC 1288337. PMID 10631161. doi:10.1086/302719.
- ↑ a b Preising MN; Paunescu K; Friedburg C; Lorenz B (junio de 2007). «Genetic and clinical heterogeneity in LCA patients. The end of uniformity». Ophthalmologe (en alemán) 104 (6): 490-8. PMID 17525851. doi:10.1007/s00347-007-1533-x.
- ↑ Koenekoop RK, Wang H, Majewski J, Wang X, Lopez I, Ren H, Chen Y, Li Y, Fishman GA, Genead M, Schwartzentruber J, Solanki N, Traboulsi EI, Cheng J, Logan CV, McKibbin M, Hayward BE, Parry DA, Johnson CA, Nageeb M; Finding of Rare Disease Genes (FORGE) Canada Consortium, Poulter JA, Mohamed MD, Jafri H, Rashid Y, Taylor GR, Keser V, Mardon G, Xu H, Inglehearn CF, Fu Q, Toomes C, Chen R (julio de 2012). «Mutations in NMNAT1 cause Leber congenital amaurosis and identify a new disease pathway for retinal degeneration». Nature Genetics 44 (9): 1035-9. PMC 3657614. PMID 22842230. doi:10.1038/ng.2356.
- ↑ «NMNAT1 mutations cause Leber congenital amaurosis». Nature Genetics 44 (9): 1040-5. julio de 2012. PMC 3454532. PMID 22842227. doi:10.1038/ng.2361.
- ↑ Chiang PW; Wang J; Chen Y; Fu Q; Zhong J; Chen Y; Yi X; Wu R; Gan H; Shi Y; Chen Y; Barnett C; Wheaton D; Day M; Sutherland J; Heon E; Weleber RG; Gabriel LA; Cong P; Chuang K; Ye S; Sallum JM; Qi M (julio de 2012). «Exome sequencing identifies NMNAT1 mutations as a cause of Leber congenital amaurosis». Nature Genetics 44 (9): 972-4. PMID 22842231. doi:10.1038/ng.2370.
- ↑ «Mutations in NMNAT1 cause Leber congenital amaurosis with early-onset severe macular and optic atrophy». Nature Genetics 44 (9): 975-7. julio de 2012. PMID 22842229. doi:10.1038/ng.2357.
- ↑ Cideciyan, Artur V.; Hauswirth, William W.; Aleman, Tomas S.; Kaushal, Shalesh; Schwartz, Sharon B.; Boye, Sanford L.; Windsor, Elizabeth A.M.; Conlon, Thomas J. et al. (13 de agosto de 2009). «Vision 1 Year after Gene Therapy for Leber’s Congenital Amaurosis». The New England journal of medicine 361 (7): 725-727. ISSN 0028-4793. PMC 2847775. PMID 19675341. doi:10.1056/NEJMc0903652. Consultado el 20 de noviembre de 2021.
- ↑ Terapia genética para niños sin visión. National Eye Institute. Archivado el 27 de enero de 2012 en Wayback Machine. Consultado el 15 de febrero de 2012
- ↑ «FDA approves Spark's gene therapy for rare blindness pioneered at CHOP - Philly». Philly.com. Consultado el 28 de mayo de 2019.
- ↑ Luxturna. European Medicines Agency. Assessment report. Consultado el 28 de mayo de 2019.
- ↑ Maguire, Albert M.; Simonelli, Francesca; Pierce, Eric A.; Pugh, Edward N.; Mingozzi, Federico; Bennicelli, Jeannette; Banfi, Sandro; Marshall, Kathleen A. et al. (22 de mayo de 2008). «Safety and Efficacy of Gene Transfer for Leber’s Congenital Amaurosis». The New England journal of medicine 358 (21): 2240-2248. ISSN 0028-4793. PMC 2829748. PMID 18441370. doi:10.1056/NEJMoa0802315. Consultado el 20 de noviembre de 2021.
