Alcaloide pirrolizidínico
Los alcaloides pirrolizidínicos (PAs, por sus siglas en inglés) son un grupo de alcaloides que presentan una estructura de pirrolizidina y se encuentran ampliamente distribuidos en el reino vegetal. Se han aislado aproximadamente 660 alcaloides con esta estructura y han sido identificados en más de 6000 plantas, además de insectos que consumen estas plantas.[1]

Presencia en la naturaleza
[editar]Estos alcaloides han sido encontrados de manera común en plantas de las familias Boraginaceae, Asteraceae, Orchidaceae y Leguminosae; son menos frecuentes en Convolvulaceae y Poaceae, y se han encontrado de manera excepcional en la familia Lamiaceae. Un número de insectos de diferentes especies han desarrollado adaptaciones para secuestrar, almacenar y utilizar los APs como defensa frente a insectos predadores.
Clasificación
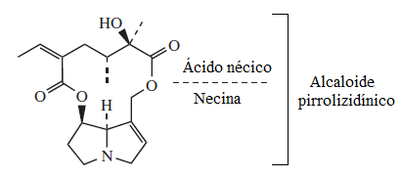
[editar]Los alcaloides pirrolizidínicos constan de 2 componentes estructurales: la necina, que es la pirrolizidina como tal, y el ácido nécico, el cual es un derivado de los aminoácidos ramificados valina, treonina, leucina o isoleucina.
Necinas
[editar]La biosíntesis de las necinas procede a partir de la homoespermidina, un dímero de la putrescina formada por la transferencia de un grupo aminobutil trasferido de la putrescina a la espermina por la acción de la homoespermidina sintasa (EC 2.5.1.45) A partir de esta etapa, se establecen los siguientes pasos:
- a) Desaminación oxidativa de un extremo de la homoespermidina.
- b) Formación de una sal de iminio por medio de una reacción de base de Schiff.
- c) Segunda desaminación oxidativa del otro grupo amina.
- d) Reacción de Mannich intramolecular

El producto de esta reacción es el (1R, 7aS)-pirrolizidin-1-carbaldehído. Existe la posibilidad de formar el isómero 1S. Este aldehído es el precursor inmediato del resto de las necinas. Las otras necinas se forman por oxidación (oxigenación o deshidrogenación). La otonecina es una hidroazonina formada por la metilación y oxidación de la retronecina.

Ácidos nécicos
[editar]Los ácidos nécicos son derivados ácidos ramificados no terpénicos que constituyen los alcaloides pirrolizidínicos de las plantas. Se consideran dos orígenes distintos: a partir del piruvato y la treonina.
- a) Ácidos nécicos del piruvato: Dos moléculas de ácido pirúvico dan una condensación tipo aciloínica con catálisis del pirofosfato de tiamina (TPP). El producto de esta reacción es el ácido acetoláctico. Este compuesto sufre una transposición tipo pinacólica con migración de un metilo para formar el ácido 3-hidroxi-3-metil-2oxobutírico. Este ácido puede producir dos reacciones posibles:
- - La descarboxilación oxidativa con coenzima A en presencia de TPP. La hidrólisis del producto forma el ácido 2-hidroxiisobutírico. La deshidratación de este ácido produce el ácido metacrílico.
- - La deshidratación e hidrogenación para formar el ácido 2-oxoisovalérico. A partir de este compuesto se puede formar la valina por transaminación.
El ácido 2-oxoisovalérico puede sufrir las siguientes transformaciones:
- - Descarboxilación oxidativa con coenzima A en presencia de TPP. La hidrólisis del producto forma el ácido isobutírico.
- - Homologación análoga a la conversión del oxaloacetato al 2-cetoglutarato en el ciclo de Krebs. El producto formado es el ácido 2-cetoisocaproico. Este ácido puede formar leucina por transaminación.
- - Reducción del grupo cetona para formar el ácido D-α-hidroxiisovalérico. La deshidratación de este ácido produce el ácido senecioico.
- - Segunda condensación aciloínica del piruvato con descarboxilación en presencia de TPP. El producto formado es el intermediario ácido (2R)-2-acetil-2-hidroxi-3-metilbutanoico. Su descarboxilación en presencia de coenzima A y TPP produce el ácido viridiflórico. Éste compuesto es precursor de los ácidos traquelánticos, el ácido equimidínico y el ácido lasiocárpico.

- b)Derivados de la treonina:
La treonina sufre dos transformaciones distintas para producir este segundo tipo de ácidos nécicos:
- - La deshidratación de la treonina produce una enamina. La hidrólisis de esta enamina (tautómero de la imina) produce el ácido 2-oxobutírico. La condensación aciloínica con descarboxilación a partir del piruvato en presencia de TPP produce el ácido (R)-2-aceto-2-hidroxibutírico. Este ácido puede dar una transposición tipo pinacólica con migración del grupo etilo para formar el ácido 3-hidroxi-3-metil-2-oxovalérico.
- - La transaminación de la treonina produce el ácido 3-hidroxi-2-cetobutírico.
El ácido 3-hidroxi-3-metil-2-oxovalérico puede seguir las siguientes rutas:
- - Sufrir descarboxilación en presencia de coenzima A en presencia de TPP para formar el ácido (R) 2-hidroxi-2-metilvalérico.
- - Sufrir deshidratación e hidrogenación para producir el ácido 3-metil-2-oxovalérico. Este ácido puede formar isoleucina por transaminación. Este mismo ácido puede descarboxilarse en presencia de TPP y coenzima A para formar el ácido dihidroxiangélico. La deshidrogenación con FAD puede producir los isómeros ácido tíglico, ácido angélico y ácido etacrílico.
Por otra parte, el ácido 3-hidroxi-2-cetobutírico puede dar una condensación aciloínica con descarboxilación a partir del piruvato en presencia de TPP para producir el ácido (R)-2-aceto-2,3-dihidroxibutírico. Este ácido puede dar una transposición tipo pinacólica con migración del grupo etilo para formar el ácido (R)-2,3-dihidroxi-3-metil-2-oxovalérico. La descarboxilación de este compuesto produce el ácido ipangulínico.

Monoésteres y diésteres
[editar]Las necinas pueden formar mono y diésteres con ácidos nécicos, ácidos grasos y fenilpropanoides.
Lactonas
[editar]Los ácidos nécicos esterificados con las necinas pueden dimerizar para formar macrodilactonas.
Alcaloides de la lolina
[editar]La lolina es una epoxipirrolizina formada a partir de la homoserina

Actividad biológica
[editar]Son hepatotóxicos.
Importancia ecológica
[editar]Muchos insectos utilizan estos alcaloides como feromonas.
Referencias
[editar]- ↑ Hartmann T (2004) Plant-derived secondary metabolites as defensive chemicals in herbivorous insects: a case study in chemical ecology. Planta 219, 1–4.
