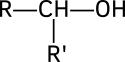Alcohol
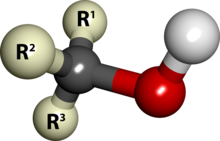

En química se denomina alcohol a aquellos compuestos químicos orgánicos que contienen un grupo hidroxilo (-OH) en sustitución de un átomo de hidrógeno, de un alcano, enlazado de forma covalente a un átomo de carbono, grupo carbinol (C-OH). Además este carbono debe estar saturado, es decir, debe tener solo enlaces sencillos a ciertos átomos[1] (átomos adyacentes). Esto diferencia a los alcoholes de los fenoles.
Si contienen varios hidroxilos se denominan polialcoholes. Los polialcoholes, polioles o “alditoles”, son sustancias cuya estructura consiste en una cadena carbonada con un grupo OH sobre cada uno de los carbonos. Los polialcoholes más importantes de interés alimentario son los obtenidos por la reducción del grupo aldehído o cetona de un monosacárido, o por la reducción del grupo carbonilo libre, si lo tiene, de un oligosacárido. Esta reducción se lleva a cabo a escala industrial con hidrógeno en presencia de níquel como catalizador. En el caso de los obtenidos a partir de disacáridos, los polialcoholes también tienen el anillo cerrado de uno de los monosacáridos, pero con el grupo carbonilo en forma no reductora. Los alcoholes pueden ser primarios (grupo hidróxido ubicado en un carbono que a su vez está enlazado a un solo carbono), alcoholes secundarios (grupo hidróxido ubicado en un carbono que a su vez está enlazado a dos carbonos) o alcoholes terciarios (grupo hidróxido ubicado en un carbono que a su vez está enlazado a tres carbonos).
Los alcoholes forman una amplia clase de diversos compuestos: son muy comunes en la naturaleza y a menudo tienen funciones importantes en los organismos. Los alcoholes son compuestos que pueden llegar a desempeñar un papel importante en la síntesis orgánica, al tener una serie de propiedades químicas únicas. En la sociedad humana, los alcoholes son productos comerciales con numerosas aplicaciones, tanto en la industria como en las actividades cotidianas; el etanol, un alcohol, lo contienen numerosas bebidas.[2]
Etimología
La palabra castellana alcohol deriva del latín medieval alcohol[3] que significa galena, polvo de estibio para maquillarse los ojos, polvo o líquido obtenido por sublimación o alcohol, este del árabe hispánico al-kuḥúl, kohl a base de polvos de galena o de estibio, y este del árabe clásico al-kuḥl الكحول, o al-ghawl الغول, «el espíritu», «toda sustancia pulverizada», «líquido destilado».[4] La palabra árabe, cognado del Arameo כוחלא / ܟܘܚܠܐ (kuḥlā) y deriva del acadio guḫlum 𒎎𒋆𒁉𒍣𒁕 que significa estibio.
Historia
Los persas conocieron el alcohol extraído del vino por destilación a partir del siglo IX. El alquimista persa Muhammad ibn Zakarīyā al-Rāzī perfeccionó sus métodos de destilación.[5] Sin embargo, en Europa su descubrimiento se remonta a principios del siglo XIV, atribuyéndose al médico Arnau de Villanova, alquimista y profesor de medicina en Montpellier. La quinta esencia de Ramon Llull no era otra cosa que el alcohol rectificado a una más suave temperatura. Lavoisier fue quien dio a conocer el origen y la manera de producir el alcohol por medio de la fermentación vínica, demostrando que bajo la influencia de la levadura de cerveza, el azúcar de uva se transforma en ácido carbónico y alcohol. Fue además estudiado por Scheele, Gehle, Thénard, Duma y Boullay y en 1854, Berthelot lo obtuvo por síntesis.[6]
Química orgánica
Nomenclatura

Los alcoholes, al igual que otros compuestos orgánicos, como las cetonas y los éteres, tienen diversas maneras de nombrarlos:
- Común (no sistemática): se antepone la palabra alcohol a la base del alcano correspondiente y se sustituye el sufijo -ano por -ílico. Así por ejemplo tendríamos
- Metano → alcohol metílico
- Etano → alcohol etílico
- Propano → alcohol propílico
- IUPAC: añadiendo una l (ele) al sufijo -ano en el nombre del hidrocarburo precursor, ejemplo
- Metano → metanol
- donde met- indica un átomo de carbono, -ano- indica que es un hidrocarburo alcano y -l que se trata de un alcohol
También se presentan alcoholes en los cuales se hace necesario identificar la posición del átomo del carbono al que se encuentra enlazado el grupo hidroxilo, por ejemplo, 2-butanol, en donde el dos significa que en el carbono dos (posición en la cadena), se encuentra ubicado el grupo hidróxido, la palabra but nos dice que es una cadena de cuatro carbonos y la -l nos indica que es un alcohol (nomenclatura IUPAC). Cuando el grupo alcohol es sustituyente, se emplea el prefijo hidroxi-. Se utilizan los sufijos -diol, -triol, etc., según la cantidad de grupos OH que se encuentre.
Para mayores detalles, consulte Nomenclatura de Hidroxicompuestos: alcoholes, fenoles y polioles.
Ejemplos
Ejemplos:
- etanol:
- butan-2-ol:
Clasificación de los alcoholes
De manera genérica, un alcohol contiene la secuencia:
- R - OH
donde R es un radical orgánico variable, a menudo un alquilo.
Según la naturaleza del carbono que lleve el grupo alcohol, se distingue:
- los alcoholes primarios, cuyo carbono que lleva el grupo hidroxilo está ligado a al menos dos átomos de hidrógeno y un radical orgánico R:

- los alcoholes secundarios, cuyo carbono que lleva el grupo hidroxilo está ligado a un átomo de hidrógeno y dos radicales orgánicos R y R':
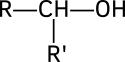
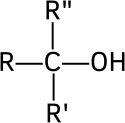
- los alcoholes terciarios, cuyo carbono que lleva el grupo hidroxilo está ligado a tres radicales orgánicos R, R′ y R″:
- los fenoles, son a veces considerados como alcoholes particulares cuyo grupo hidroxilo está ligado a un carbono de un anillo bencénico. Su reactividad es tan diferente de los otros alcoholes (aquí el carbono que lleva el grupo -OH no es tetraédrico), los fenoles se clasifican generalmente fuera de la familia de los alcoholes.
- Existe también un grupo considerado a veces como un caso particular de alcoholes llamados enoles. Se trata de una molécula en la cual el grupo hidroxilo se ha ligado sobre un carbono de un doble enlace C=C (aquí el carbono que lleva el grupo -OH no es tetraédrico). Se trata en realidad de una forma tautómera de un aldehído o de unea cetona. La forma mayoritaria es generalmente el aldehído o la cetona, y no el enol, salvo casos particulares donde la forma enol está estabilizada por mesomería como los fenoles.
Formulación
Los monoalcoholes derivados de los alcanos responden a la fórmula general CnH2n+1OH.
Propiedades generales
Los alcoholes suelen ser líquidos incoloros de olor característico, solubles en el agua en proporción variable y menos densos que ella. Al aumentar la masa molecular también aumentan sus puntos de fusión y ebullición, pudiendo ser sólidos a temperatura ambiente (por ejemplo el pentaerititrol funde a 260 °C). A diferencia de los alcanos de los que derivan, el grupo funcional hidroxilo permite que la molécula sea soluble en agua debido a la similitud del grupo hidroxilo con la molécula de agua y le permite formar enlaces de hidrógeno. La solubilidad de la molécula depende del tamaño y forma de la cadena alquílica, ya que a medida que la cadena alquílica sea más larga y más voluminosa, la molécula tenderá a parecerse más a un hidrocarburo y menos a la molécula de agua, por lo que su solubilidad será mayor en disolventes apolares, y menor en disolventes polares. Algunos alcoholes (principalmente polihidroxílicos y con anillos aromáticos) tienen una densidad mayor que la del agua.
El hecho de que el grupo hidroxilo pueda formar enlaces de hidrógeno también afecta a los puntos de fusión y ebullición de los alcoholes. A pesar de que el enlace de hidrógeno que se forma sea muy débil en comparación con otros tipos de enlaces, se forman en gran número entre las moléculas, configurando una red colectiva que dificulta que las moléculas puedan escapar del estado en el que se encuentren (sólido o líquido), aumentando así sus puntos de fusión y ebullición en comparación con sus alcanos correspondientes. Además, ambos puntos suelen estar muy separados, por lo que se emplean frecuentemente como componentes de mezclas anticongelantes. Por ejemplo, el 1,2-etanodiol tiene un punto de fusión de -16 °C y un punto de ebullición de 197 °C.
Propiedades físico-químicas
Aspecto
Los alcoholes de bajo peso molecular se presentan a temperatura ambiente como líquidos incoloros; los alcoholes más pesados, como sólidos blanquecinos.
Polaridad y presencia de enlaces hidrógeno
El grupo hidroxilo hace polar generalmente a la molécula de alcohol. Esto es debido a su geometría en codo, y a las electronegatividades respectivas del carbono, de oxígeno y del hidrógeno (χ(O) > χ(C) > χ(H)). Estos grupos pueden formar enlaces de hidrógeno entre ellos o con otros compuestos (lo que explica su solubilidad en el agua y en los otros alcoholes).
Punto de ebullición
El punto de ebullición es elevado en los alcoholes:
- por el grupo hidroxilo que permite los enlaces de hidrógeno;
- por la cadena carbonada que soporta fuerzas de van der Waals.
También, el punto de ebullición de los alcoholes es tanto más elevado cuanto:
- más alto es el número de funciones alcohol: un diol tiene una temperatura de ebullición superior a la de un alcohol simple equivalente, que el mismo la tiene superior al hidrocarburo correspondiente. Por ejemplo, entre los alcoholes derivados del isopropano, el glicerol (propan-1,2,3-triol) hierve a 290 °C, el propilen glicol (propan-1,2-diol) a 187 °C, el propan-1-ol a 97 °C, y el propano a −42,1 °C;
- más larga es la cadena carbonada: entre los alcoholes lineares, el metanol hierve a 65 °C, el etanol a 78 °C, el propan-1-ol a 97 °C, el butan-1-ol a 118 °C, el pentan-1-ol a 138 °C y el hexan-1-ol a 157 °C;
- cuando la cadena carbonada es lineal, por maximización de la superficie de la molécula susceptible de soportar las fuerzas de van der Waals. Por ejemplo, entre los pentanoles, el 2,2-dimetilpropan-1-ol hierve a 102 °C, el 2-metilbutan-1-ol a 131 °C y el pentan-1-ol a 138 °C.
Solubilidad
La solubilidad en el agua de los alcoholes depende de los dos mismos factores mencionados previamente, pero en este caso son antagonistas:
- la cadena carbonada, que es hidrófoba, tiende a volver la molécula no soluble en agua;
- el grupo hidroxilo, que es hidrófilo (gracias a sus enlaces hidrógeno), tiende a hacer la molécula soluble.
De esta manera, los alcoholes son tanto más solubles en agua cuanto:
- más corta es la cadena carbonada: el metanol, el etanol, el propan-1-ol y el propan-2-ol son solubles en todas proporciones en el agua, el butan-1-ol tiene una solubilidad de 77 g/L a 20 °C, el pentan-1-ol de 22 g/L, el hexan-1-ol de 5,9 g/L, el heptan-1-ol de 2 g/L y los alcoholes más pesados son prácticamente insolubles;
- más alto es el número de funciones alcohol. Por ejemplo, los butanodioles son solubles en todas las proporciones mientras que el butan-1-ol tiene una solubilidad de 77 g/L;
- la cadena carbonada está ramificada: entre los pentanoles, el 2,2-dimetil-propan-1-ol tiene una solubilidad de 102 g/L, el 2-metil-Bután-1-ol de 100 g/L y el pentan-1-ol de 22 g/L.
Los alcoholes de bajo peso molecular son generalmente solubles en los solventes orgánicos como la acetona o el éter.
Propiedades químicas de los alcoholes
Los alcoholes pueden comportarse como ácidos o como bases gracias a que el grupo funcional es similar al agua, por lo que se establece un dipolo muy parecido al que presenta la molécula de agua.
Por un lado, si se enfrenta un alcohol con una base fuerte o con un hidruro de metal alcalino se forma el grupo alcoxi, en donde el grupo hidroxilo se desprotona dejando al oxígeno con carga negativa. La acidez del grupo hidroxilo es similar a la del agua, aunque depende fundamentalmente del impedimento estérico y del efecto inductivo. Si un hidroxilo se encuentra enlazado a un carbono terciario, este será menos ácido que si se encontrase enlazado a un carbono secundario, y a su vez este sería menos ácido que si estuviese enlazado a un carbono primario, ya que el impedimento estérico impide que la molécula se solvate de manera efectiva. El efecto inductivo aumenta la acidez del alcohol si la molécula posee un gran número de átomos electronegativos unidos a carbonos adyacentes (los átomos electronegativos ayudan a estabilizar la carga negativa del oxígeno por atracción electrostática).
Por otro lado, el oxígeno posee dos pares electrónicos no compartidos, por lo que el hidroxilo podría protonarse, aunque en la práctica esto conduce a una base muy débil, por lo que para que este proceso ocurra, es necesario enfrentar al alcohol con un ácido muy fuerte.
Halogenación de alcoholes
Para fluorar cualquier alcohol se requiere del reactivo de Olah o el reactivo de Ishikawa.
Para clorar alcoholes, se deben tomar en cuenta las siguientes consideraciones:
- Alcohol primario: los alcoholes primarios reaccionan muy lentamente. Como no pueden formar carbocationes, el alcohol primario activado permanece en solución hasta que es atacado por el ion cloruro. Con un alcohol primario, la reacción puede tomar desde treinta minutos hasta varios días.
- Alcohol secundario: los alcoholes secundarios tardan menos tiempo, entre 5 y 20 minutos, porque los carbocationes secundarios son menos estables que los terciarios.
- Alcohol terciario: los alcoholes terciarios reaccionan casi instantáneamente, porque forman carbocationes terciarios relativamente estables.
Los alcoholes terciarios reaccionan con ácido clorhídrico directamente para producir el cloroalcano terciario, pero si se usa un alcohol primario o secundario es necesaria la presencia de un ácido de Lewis, un "activador", como el cloruro de zinc. También se puede obtener por reacción de Appel. La conversión puede ser llevada a cabo directamente usando cloruro de tionilo (SOCl2) como alternativa.
Dos ejemplos:
- (H3C)3C-OH + HCl → (H3C)3C-Cl + H2O
- CH3-(CH2)6-OH + SOCl2 → CH3-(CH2)6-Cl + SO2 + HCl
Un alcohol puede también ser convertido a bromoalcano usando ácido bromhídrico o tribromuro de fósforo (PBr3).
Se reemplaza el grupo hidroxilo por un yodo para formar el yodoalcano usando fósforo rojo y yodo para generar "in situ" el triyoduro de fósforo.
Oxidación de alcoholes
- Metanol: Existen diversos métodos para oxidar metanol a formaldehído y/o ácido fórmico, como la reacción de Adkins-Peterson.
- Alcohol primario: se utiliza la piridina (Py) para detener la reacción en el aldehído CrO3/H+ se denomina reactivo de Jones, y se obtiene un ácido carboxílico.
- Alcohol secundario: los alcoholes secundarios tardan menos tiempo, entre 5 y 10 minutos, porque los carbocationes secundarios son menos estables que los terciarios.
- Alcohol terciario: si bien se resisten a ser oxidados con oxidantes suaves, si se utiliza un enérgico como lo es el permanganato de potasio, los alcoholes terciarios se oxidan dando como productos una cetona con un número menos de átomos de carbono, y se libera metano.
Deshidratación de alcoholes
La deshidratación de alcoholes es un proceso químico que consiste en la transformación de un alcohol para poder ser un alqueno por procesos de eliminación. Para realizar este procedimiento se utiliza un ácido mineral para extraer el grupo hidroxilo (OH) desde el alcohol, generando una carga positiva en el carbono del cual fue extraído el Hidroxilo el cual tiene una interacción eléctrica con los electrones más cercanos (por defecto, electrones de un hidrógeno en el caso de no tener otro sustituyente) que forman un doble enlace en su lugar.
Por esto, la deshidratación de alcoholes es útil, puesto que fácilmente convierte a un alcohol en un alqueno.
Un ejemplo simple es la síntesis del ciclohexeno por deshidratación del ciclohexanol. Se puede ver la acción del ácido (H2SO4) ácido sulfúrico el cual quita el grupo hidroxilo del alcohol, generando el doble enlace y agua. Si se requiere deshidratar un alcohol en condiciones más suaves se puede utilizar el reactivo de Burgess.
Fuentes
Muchos alcoholes pueden ser creados por fermentación de frutas o granos con levadura, pero solamente el etanol es producido comercialmente de esta manera, principalmente como combustible y como bebida. Otros alcoholes son generalmente producidos como derivados sintéticos del gas natural o del petróleo.
Usos
Los alcoholes tienen una gran gama de usos en la industria y en la ciencia como disolventes y combustibles. El etanol y el metanol pueden hacerse combustionar de una manera más limpia que la gasolina o el gasoil. Por su baja toxicidad y disponibilidad para disolver sustancias no polares, el etanol es utilizado frecuentemente como disolvente en fármacos, perfumes y en esencias vitales como la vainilla. Los alcoholes sirven frecuentemente como versátiles intermediarios en la síntesis orgánica.
El alcohol isopropílico o 2-propanol tiene gran importancia por sus aplicaciones industriales por ser un muy buen disolvente orgánico, siendo empleado para el tratamiento de resinas, gomas y lacas, como desnaturalizante del alcohol etílico mezclado con otros compuestos y en la fabricación de acetona.[7]
El etanol es el único alcohol que se puede ingerir, de hecho, es el principal componente de las bebidas alcohólicas.
Toxicidad en el consumo humano

El etanol es un líquido incoloro, volátil y de olor suave que se puede obtener a partir de la fermentación de azúcares. A escala industrial es más habitual su obtención a partir de la hidratación del etileno (una reacción del etileno con el agua en presencia de ácido fosfórico). El etanol es el depresor más utilizado en el mundo, y así lleva siéndolo desde hace milenios; su consumo es adictivo y puede conducir al alcoholismo.
El etanol presente en las bebidas alcohólicas ha sido consumido por los humanos desde tiempos prehistóricos por una serie de razones higiénicas, dietéticas, medicinales, religiosas y recreativas. El consumo de grandes dosis de etanol causa embriaguez (intoxicación alcohólica), que puede provocar resaca una vez se han terminado los efectos. Según la dosis y la frecuencia con que se consuma, el etanol puede causar coma etílico, pérdida de conocimiento, una parálisis respiratoria aguda o incluso la muerte. Como el etanol perjudica las habilidades cognitivas, puede incitar a comportamientos temerarios o irresponsables. La toxicidad del etanol es causada en gran medida por su principal metabolito, el acetaldehído[9] y su metabolito secundario, el ácido acético.[10]
La dosis letal mediana (DL50) del etanol en ratas es de 10 300 mg/kg.[11] Otros alcoholes son significativamente más tóxicos que el etanol, en parte porque tardan mucho más en ser metabolizados y en parte porque su metabolización produce sustancias (metabolitos) que son aún más tóxicas. El metanol (alcohol de madera), por ejemplo, es oxidado en el hígado, con lo que se forma la sustancia venenosa formaldehído por la enzima alcohol deshidrogenasa; esto puede provocar ceguera o la muerte.[12] Un tratamiento eficaz para evitar la intoxicación por formaldehído tras ingerir metanol es administrar etanol. La enzima alcohol deshidrogenasa tiene una mayor afinidad por el etanol, evitando así que el metanol se una y sirva de sustrato. De esta forma, el resto de metanol tendrá tiempo de ser excretado por los riñones. El formaldehído que quede será convertido en ácido fórmico y después excretado.[13][14]
El metanol en sí, a pesar de ser venenoso, tiene un efecto sedante mucho menos potente que el etanol. Algunos alcoholes de cadena larga como por ejemplo el n-propanol, el isopropanol, el n-butanol, el t-butanol y el 2-metil-2-butanol sí tienen efectos sedantes más potentes, aunque también son más tóxicos que el etanol.[15][16] Estos alcoholes de cadena larga se encuentran como contaminantes en algunas bebidas alcohólicas y son conocidos como alcoholes de fusel,[17][18] y tienen la reputación de causar una resaca grave, aunque no está claro si los alcoholes de fusel son la auténtica causa.[19] Muchos alcoholes de cadena larga son utilizados por la industria como disolventes,[20] y a veces están detrás de una variedad de problemas de salud asociados al alcoholismo.[21] Aunque el mecanismo no está claro, un meta análisis de 572 estudios han demostrado un aumento del riesgo de cáncer asociado al consumo de alcohol.[22]
Alcohol de botiquín
El alcohol de botiquín puede tener varias composiciones. Puede ser totalmente alcohol etílico al 96°, con algún aditivo como el cloruro de benzalconio o alguna sustancia para darle un sabor desagradable. Es lo que se conoce como alcohol etílico desnaturalizado. También se utilizan como desnaturalizantes el ftalato de dietilo y el metanol, lo cual hace tóxicos a algunos alcoholes desnaturalizados.
Otras composiciones: podría contener alcohol isopropílico, no es apto para beber, pero puede ser más efectivo para el uso como secante.
La adición de estas sustancias se hizo necesaria ya que las personas que padecen alcoholemia la consumían en grandes cantidades por su bajo costo y fácil adquisición, cabe indicar que se trata del mismo compuesto, alcohol etílico.
Véase también
Referencias
- ↑ Unión Internacional de Química Pura y Aplicada. «Alcohols». Compendium of Chemical Terminology. Versión en línea (en inglés).
- ↑ Figuero, E; Carretero, M; Cerero, R; Esparza, G; Moreno, L (2004). «Efectos del consumo de alcohol etílico en la cavidad oral: Relación con el cáncer oral». Medicina y Patología Oral 9. p. 14. ISSN 1137-2834.
- ↑ Real Academia Española. «alcohol». Diccionario de la lengua española (23.ª edición). Consultado el 2 de octubre de 2022.
- ↑ «alcohol». Online Etymology Dictionary (en inglés). Consultado el 2 de octubre de 2022.
- ↑ Modanlou, HD (noviembre de 2008). «A tribute to Zakariya Razi (865 - 925 AD), an Iranian pioneer scholar». Archives of Iranian medicine (en inglés) 11 (6). Teherán: Academy of Medical Sciences of Iranian Medicine. pp. 673-677. ISSN 1029-2977. OCLC 269410950. PMID 18976043.
- ↑ Diccionario enciclopédico popular ilustrado Salvat (1906-1915)
- ↑ Biasioli, Weitz, Chandías, Química Orgánica (1993). «13». Química Orgánica. Argentina: Kapelusz. p. 255. ISBN 950-13-2037-5.
- ↑ (en inglés) Fuente: 'CDC: Centers for Disease Control and Prevention'.
- ↑ Steven Wm. Fowkes. «Living with Alcohol». CERI (en inglés). The Cognitive Enhancement Research Institute. Archivado desde el original el 29 de febrero de 2000. Consultado el 1 de octubre de 2016.
- ↑ Maxwell, Christina R.; Spangenberg, Rebecca Jay; Hoek, Jan B.; Silberstein, Stephen D.; Oshinsky, Michael L. (2010). «Acetate causes alcohol hangover headache in rats». PloS One 5 (12): e15963. ISSN 1932-6203. PMID 21209842. doi:10.1371/journal.pone.0015963. Consultado el 1 de octubre de 2016.
- ↑ Gable, Robert S. (junio de 2004). «Comparison of acute lethal toxicity of commonly abused psychoactive substances». Addiction (en inglés) 99 (6): 686-696. ISSN 1360-0443. doi:10.1111/j.1360-0443.2004.00744.x.
- ↑ Argonne National Laboratory. «Connecting Argonne science to the classroom». anl.gov (en inglés). Consultado el 1 de octubre de 2016.
- ↑ Zimmerman, H. E.; Burkhart, K. K.; Donovan, J. W. (abril de 1999). «Ethylene glycol and methanol poisoning: diagnosis and treatment». Journal of emergency nursing: JEN: official publication of the Emergency Department Nurses Association 25 (2): 116-120. ISSN 0099-1767. PMID 10097201.
- ↑ Lobert, S. (1 de diciembre de 2000). «Ethanol, isopropanol, methanol, and ethylene glycol poisoning». Critical Care Nurse 20 (6): 41-47. ISSN 0279-5442. PMID 11878258. Consultado el 1 de octubre de 2016.
- ↑ McKee, Martin; Suzcs, Sándor; Sárváry, Attila; Adany, Roza; Kiryanov, Nikolay; Saburova, Ludmila; Tomkins, Susannah; Andreev, Evgeny et al. (octubre de 2005). «The composition of surrogate alcohols consumed in Russia». Alcoholism, Clinical and Experimental Research 29 (10): 1884-1888. ISSN 0145-6008. PMID 16269919.
- ↑ Bunc, M.; Pezdir, T.; Mozina, H.; Mozina, M.; Brvar, M. (abril de 2006). «Butanol ingestion in an airport hangar». Human & Experimental Toxicology 25 (4): 195-197. ISSN 0960-3271. PMID 16696295.
- ↑ Woo, Kang-Lyung. «Determination of low molecular weight alcohols including fusel oil in various samples by diethyl ether extraction and capillary gas chromatography». Journal of AOAC International 88 (5): 1419-1427. ISSN 1060-3271. PMID 16385992.
- ↑ Lachenmeier, Dirk W.; Haupt, Simone; Schulz, Katja (abril de 2008). «Defining maximum levels of higher alcohols in alcoholic beverages and surrogate alcohol products». Regulatory toxicology and pharmacology: RTP 50 (3): 313-321. ISSN 0273-2300. PMID 18295386. doi:10.1016/j.yrtph.2007.12.008.
- ↑ Hori, Hisako; Fujii, Wataru; Hatanaka, Yutaka; Suwa, Yoshihide (agosto de 2003). «Effects of fusel oil on animal hangover models». Alcoholism, Clinical and Experimental Research 27 (8 Suppl): 37S-41S. ISSN 0145-6008. PMID 12960505. doi:10.1097/01.ALC.0000078828.49740.48.
- ↑ Mańkowski, W.; Klimaszyk, D.; Krupiński, B. (2000). «[How to differentiate acute isopropanol poisoning from ethanol intoxication? -- a case report]». Przegla̧d Lekarski 57 (10): 588-590. ISSN 0033-2240. PMID 11199895.
- ↑ Bogomolova, I. N.; Bukeshov, M. K.; Bogomolov, D. V. «[The forensic medical diagnosis of intoxication of alcohol surrogates by morphological findings]». Sudebno-Meditsinskaia Ekspertiza 47 (5): 22-25. ISSN 0039-4521. PMID 15523882. Consultado el 1 de octubre de 2016.
- ↑ Bagnardi, V.; Rota, M.; Botteri, E.; Tramacere, I.; Islami, F.; Fedirko, V.; Scotti, L.; Jenab, M. et al. (3 de febrero de 2015). «Alcohol consumption and site-specific cancer risk: a comprehensive dose–response meta-analysis». British Journal of Cancer (en inglés) 112 (3): 580-593. ISSN 0007-0920. doi:10.1038/bjc.2014.579.
- Este artículo es una obra derivada de «Las drogas tal cual...» por Karina Malpica, publicada en mindsurf. Texto reproducido con la autorización de la autora bajo la licencia GNU Free Documentation License.
Enlaces externos
 Wikcionario tiene definiciones y otra información sobre alcohol.
Wikcionario tiene definiciones y otra información sobre alcohol. Wikiquote alberga frases célebres de o sobre Alcohol.
Wikiquote alberga frases célebres de o sobre Alcohol. Wikimedia Commons alberga una galería multimedia sobre Alcohol.
Wikimedia Commons alberga una galería multimedia sobre Alcohol.- Consumo de alcohol, salud y sociedad; resumen realizado por GreenFacts de un informe de la OMS.