Ácido difosfórico
| Ácido difosfórico | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| μ-óxido-bis(dihidroxidooxidofósforo) o tetrahidrogeno(heptaoxidodisulfato) | ||
| General | ||
| Otros nombres |
Ácido pirofosfórico Fosfato (V) de hidrógeno | |
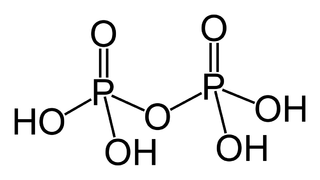
| Fórmula estructural |
 | |
| Fórmula molecular | H4P2O7 | |
| Identificadores | ||
| Número CAS | 2466-09-3[1] | |
| ChEBI | 29888 | |
| ChEMBL | CHEMBL1160571 | |
| ChemSpider | 996 | |
| DrugBank | DB04160 | |
| PubChem | 21961011 1023, 21961011 | |
| UNII | 4E862E7GRQ | |
| KEGG | C00013 | |
| Propiedades físicas | ||
| Masa molar | 177,98 g/mol | |
| Punto de fusión | 344,5 K (71 °C) | |
| Propiedades químicas | ||
| Solubilidad en agua | Muy soluble en agua y en alcohol | |
| Peligrosidad | ||
| NFPA 704 |
?
?
?
?
| |
| Compuestos relacionados | ||
| Compuestos relacionados |
Ácido metafosfórico Ácido fosfórico | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El ácido difosfórico o también llamado ácido pirofosfórico es un oxácido de fósforo(V) de fórmula molecular H4P2O7. En realidad es un dímero del ácido ortofosfórico (H3PO4) que se forma cuando dos moléculas de este ácido pierden, entre ambos, una molécula de agua por calentamiento a 200-300 °C, por lo que, descriptivamente, queda mejor definido por su fórmula estructural:

A temperatura ambiente es un sólido incoloro e inodoro y soluble en agua, éter dietílico y alcohol etílico. El ácido anhidro presenta polimorfismo cristalino, con dos ordenamientos cristalinos o polimorfos, que se funden a 54,3 y 71,5 °C. Los aniones, sales y ésteres del ácido pirofosfórico se denominan pirofosfatos.
Preparación
[editar]El ácido pirosfosfórico se puede preparar por reacción del ácido fosfórico con cloruro de fosforilo: [2]
También se puede preparar por intercambio iónico a partir de pirofosfato de sodio o por tratamiento de pirofosfato de plomo con sulfuro de hidrógeno.[3]
Otra vía de obtención es a partir del ácido fosfórico. Cuando se calienta entre 200 y 300 °C pierde una molécula de agua por cada dos de ácido ortofosfórico.[4] Sin embargo este procedimiento no permite obtener ácido pirofosfórico puro, pues la polimerización del ácido ortofosfórico puede continuar, sobre todo si aumenta la temperatura, hasta producir ácido metafosfórico, obteniéndose una mezcla de ácidos orto, piro y polifosfóricos. La concentración máxima de ácido pirofosfórico que se puede obtener por este procedimiento es inferior al 50 %. [5]
Véase también
[editar]Referencias
[editar]- ↑ Número CAS
- ↑ R. Klement (1963). «Condensed Orthophosphates». En G. Brauer, ed. Handbook of Preparative Inorganic Chemistry (2 edición). Academic Press. p. 546.
- ↑ Wiley‐VCH Verlag GmbH & Co. KGaA, ed. (15 de junio de 2000). Ullmann's Encyclopedia of Industrial Chemistry (en inglés) (1 edición). Wiley. ISBN 978-3-527-30385-4. doi:10.1002/14356007.a19_465.pub4. Consultado el 9 de octubre de 2024.
- ↑ Morcillo, J. (1980). «Cap. 22.4. Ácidos del fósforo; ácido fosfórico y fosfatos». Temas básicos de Química. Madrid: Alhambra. ISBN 84-205-0382-7.
- ↑ Korte, Carsten; Conti, Fosca; Wackerl, Jürgen; Lehnert, Werner (2016). Li, Qingfeng, ed. Phosphoric Acid and its Interactions with Polybenzimidazole-Type Polymers (en inglés). Springer International Publishing. pp. 169-194. ISBN 978-3-319-17081-7. doi:10.1007/978-3-319-17082-4_8. Consultado el 9 de octubre de 2024.


