Ácido glucurónico
| ácido glucurónico | ||
|---|---|---|
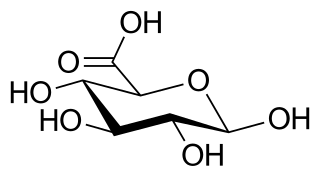 Estructura química del ácido glucurónico. | ||
| General | ||
| Otros nombres | ion glucuronato | |
| Fórmula molecular | C6H10O7 | |
| Propiedades químicas | ||
| Solubilidad en agua | Alta | |
| Compuestos relacionados | ||
El ácido glucurónico (del griego: γλυκερός, dulce) es un ácido carboxílico similar a la glucosa que presenta un grupo carboxilo en el carbono 6. Su fórmula química es C6H10O7. Las sales de este ácido se denominan glucuronatos; el anión, C6H9O7−, es el ion glucuronato.
Debe evitarse la confusión entre el ácido glucurónico y el ácido glucónico, y este último es un ácido carboxílico lineal resultante de la oxidación de un átomo de carbono distinto del 6 de la glucosa.
Glucuronidación
[editar]El ácido glucurónico es altamente hidrosoluble; de hecho, en la fisiología animal es común emplearlo conjugado a toda clase de sustancias xenobióticas a fin de hacer sencillo su excreción. Entre estos conjugados destacan drogas, bilirrubina, algunas hormonas y ácidos biliares. Este proceso de conjugación recibe el nombre de glucuronidación.[1]
La glucuronidación consiste en la formación de un enlace glucosídico del ácido glucurónico a partir de glucuronado uridin difosfato y un sustrato xenobiótico amínico o alcohólico. Es catalizada por cualquiera de los varios tipos de UDP-glucuronosiltransferasas.
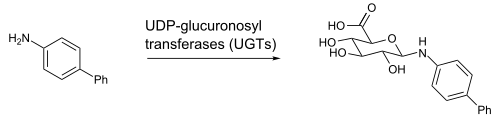
El ácido UDP-glucurónico (ácido glucurónico unido mediante un enlace glicosídico al difosfato de uridina) es un intermediario en la biotransformación y se forma en el hígado. Un ejemplo es la N-glucuronidación de el 4-aminobifenilo, una anilina que da la glucuronidación en el sustituyente amino. Esta reacción es catalizada por las enzimas UGT1A4 o UGT1A9 de hígado humano, de rata o de ratón.[2]
Las sustancias resultantes de la glucuronidación se conocen como glucurónidos (o glucurónidósidos) y son típicamente mucho más solubles en agua que los sustratos xenobióticos. El cuerpo humano usa la glucuronidación para hacer que una gran variedad de xenobióticos, como fármacos y toxinas, sean más solubles en agua y, de esta forma, permitir su posterior eliminación del cuerpo a través de la orina o las heces (a través de la bilis del hígado). Muchas hormonas liposolubles se glucuronidan para permitir un transporte más fácil por todo el cuerpo. Los farmacólogos han vinculado los medicamentos al ácido glucurónico para permitir una entrega más efectiva de una amplia gama de terapias potenciales. A veces, las sustancias tóxicas también son menos tóxicas después de la glucuronidación.
Referencias
[editar]- ↑ King C, Rios G, Green M, Tephly T (2000). «UDP-glucuronosyltransferases». Curr. Drug Metab. 1 (2): 143-61. PMID 11465080. doi:10.2174/1389200003339171.
- ↑ Al-Zoughool M., Talaska, G. (2006). «4-Aminobiphenyl N-glucuronidation by liver microsomes: optimization of the reaction conditions and characterization of the UDP-glucoronosyltransferase isoforms». J. Appl. Toxicology 26 (6): 524-532. PMID 17080401. doi:10.1002/jat.1172.
Bibliografía
[editar]- Chiu SH, Huskey SW (1998). «Species differences in N-glucuronidation» (abstract). Drug Metab. Dispos. 26 (9): 838-47. PMID 9733661.