Tampón químico

Un tampón, disolución amortiguadora, disolución buffer o disolución reguladora es una mezcla en concentraciones relativamente elevadas de un ácido débil y su base conjugada, es decir, sales hidrolíticamente activas (también puede ser de bases débiles y su ácido conjugado). Tienen la propiedad de mantener estable el pH de una disolución frente a la adición de cantidades relativamente pequeñas de ácidos o bases fuertes. Este hecho es de vital importancia en diversos contextos en donde es necesario mantener el pH en un umbral estrecho, por ejemplo, con un leve cambio en la concentración de hidrogeniones en la célula se puede producir un paro en la actividad de las enzimas.
Se puede entender esta propiedad como consecuencia del efecto ion común y las diferentes constantes de acidez o basicidad: una pequeña cantidad de ácido o base desplaza levemente el equilibrio ácido-base débil, lo cual tiene una consecuencia menor sobre el pH.[1]
Cada sistema tampón tiene su propio rango efectivo de pH, el cual dependerá de la constante de equilibrio del ácido o base empleado. Son importantes en el laboratorio y en la industria, y también en la química de la vida. Tampones típicos son los pares conjugados amonio/amoniaco, ácido acético/ acetato, carbonato ácido (bicarbonato)/carbonato, ácido cítrico/ citrato o alguno de los pares en la disociación del ácido fosfórico.
Mecanismo de actuación de las soluciones tampón[editar]
Para poder entender con claridad el mecanismo de tamponamiento de las disoluciones reguladoras, consideremos una mezcla de ácido acético y su sal sódica en disolución acuosa. Debido al efecto disociante del agua, en la disolución resultante tendremos:
Dado que el ácido acético es un ácido débil, este solo se disocia en parte, en la disolución final tendremos una mezcla de acetato y de ácido acético con un pH que vendrá determinado por la constante de disociación del ácido acético:
Cuando se añade una pequeña cantidad de ácido fuerte a esta mezcla, el equilibrio se rompe debido al aporte de iones H+ del ácido fuerte, por lo que, de acuerdo al principio de Le Châtelier, se produce un desplazamiento de dicho equilibrio hacia la izquierda, hasta que se vuelva a cumplir la expresión matemática de la constante de acidez. De manera similar ocurre si se agrega una base fuerte a la mezcla. En este caso, parte de los iones de hidrógeno son neutralizados, disminuyendo su concentración, lo que fuerza a que el equilibrio se desplace hacia la derecha. De esta forma, resulta que un electrólito débil, como en este caso el ácido acético, se disocia menos de lo esperado cuando a la disolución se añade un electrólito fuerte que aporte iones comunes, como H+, o que los neutralice[1][2].
Cálculo del pH de las disoluciones tampón[editar]
El equilibrio de disociación del ácido acético puede generalizarse para cualquier ácido débil monoprótico, que para simplificar se puede denominar como HA.
con lo que la expresión matemática de su constante de equilibrio se podría escribir, también de forma generalizada, como:
Despejando [H+]:
La ecuación puede ser expresada en forma logarítmica
Cambiando de signo la expresión
Si tenemos en cuenta que en la notación química el logaritmo negativo de [H+] se denomina pH y que el logaritmo negativo de la constante de disociación de los ácidos débiles se denomina pKa, la expresión anterior puede escribirse como:
Esta expresión matemática se conoce como ecuación de Henderson-Hasselbalch y permite el cálculo del pH en soluciones reguladoras de forma rápida, aunque aproximada, ya que no es aplicable en todos los casos, solo en aquellos en que la constante de acidez es mayor de 1,0 x 10-14. Los ácidos extremadamente débiles, con constantes de acidez inferiores a 1,0 x 10-14 o en aquellos sistemas tamponados en que las concentraciones del ácido, de su base conjugada o de ambos son muy bajas, se producen desviaciones de esta ecuación, en algunos casos bastante importantes.
Un rápido vistazo a la ecuación de Henderson-Hasselbalch permite constatar algunas de las características de las disoluciones reguladoras. La primera de ellas, es que al depender el pH de la disolución de una relación de concentraciones, dicho pH no se ve, en principio, afectado por la dilución. Otra característica importante es que el pH resultante al preparar la disolución reguladora será igual al pKa del ácido, si la concentración de éste es igual a la de su base conjugada. La más importante de las características, la del efecto regulador o tamponador también se deduce de esta ecuación. Por tratarse de una relación logarítmica de concentraciones, tiene que variar mucho la relación entre el numerador y el denominador para que la variación del pH sea muy significativa. Así, partiendo del supuesto de una disolución reguladora formada por la mezcla de un mol de ácido acético con un mol de acetato sódico y un volumen final de un litro de disolución, el pH sería de 4,76, que es el pKa del ácido acético. Si sobre esta disolución se añadiera 0,1 moles de hidróxido sódico, que es una base fuerte, esta reaccionaría con el ácido acético, neutralizando la parte equivalente y formando igual cantidad de acetato sódico que se sumaría al ya existente en la disolución. Como consecuencia, en la nueva disolución se tendría 0,9 moles de ácido acético y 1,1 de acetato. Sustituyendo en la ecuación de Henderson-Hasselbalch y sin considerar la dilución, ya que como se ha comentado, no tiene gran efecto, el nuevo pH sería de 4.85, ligeramente superior al pH original (aprox. 0,1 unidad). Si en lugar de 0,1 mol de NaOH se hubiera añadido la nada despreciable cantidad de 0,5 moles, en este caso, el pH habría aumentado solo en aproximadamente 0,5 unidades a pesar de que con esta adición de base fuerte se neutraliza la mitad del ácido presente.
La ecuación de Henderson-Hasselbalch también puede ser utilizada para los cálculos de pH de las disoluciones amortiguadoras en las que están implicados sistemas ácido/base polipróticos. Simplemente hay que tener en cuenta que ahora están involucrados más de un equilibrio de disociación. Así, por ejemplo, en el caso del ácido carbónico, cuyo efecto regulador es de gran importancia en los seres vivos, se pueden dar dos posibles equilibrios de disociación:
Puesto que por cada equilibrio hay una constante de acidez (o pKa), para el cálculo del pH es necesario considerar cada par conjugado por separado, pues hay dos sistemas conjugados; H2CO3/HCO3- y HCO3-/CO32- y por consiguiente, dos zonas de tamponamiento, una en el entorno de pH = pKa1 y la otra para pH = pKa2 . Para cada una de estas zonas de tamponamiento sería de aplicación la ecuación de Henderson-Hasselbalch siempre y cuando la diferencia entre los dos pKa sea superior a dos unidades, ya que en estos casos se considera que el otro equilibrio tiene un efecto despreciable sobre el considerado para el cálculo. En los casos en que esta situación no se da, como por ejemplo en las disoluciones de ácido glutárico, cuyos pKa son 4,3 y 5,4, respectivamente, el cálculo preciso del pH es algo más complejo, pues es necesario considerar los dos equilibrios de disociación de forma simultánea. Esta consideración es extensible a cualquier sistema poliprótico, como sería el caso del ácido fosfórico (H3PO4 ), con tres pKa: pKa1 = 2,15, pKa2 = 7,20 y pKa3 = 12,15.
Capacidad tamponadora o de amortiguación[editar]
La capacidad tamponadora (también capacidad amortiguadora o capacidad reguladora) de las disoluciones tampón, se define como la relación diferencial entre la cantidad de ácido o base fuerte añadida a la disolución y la variación del pH producida, es decir la diferencia entre el pH inicial y el resultante tras la adición. Se suele expresar por la letra griega β, que siempre ha de tener un valor positivo[3].En sí misma, es una medida cuantitativa de la resistencia de una solución tampón al cambio de pH tras la adición de un ácido o una base fuerte:
si lo que se añade es una base fuerte, y
si lo que se añade es un ácido fuerte. El signo negativo tiene en cuenta que en este caso el pH disminuye (variación negativa). La capacidad de tamponamiento, β, depende de la concentraciones del ácido y su base conjugada y de la suma conjunta de ambos y además, para el cálculo es necesario tener en cuenta el equilibrio de autoprotólisis del agua:
La siguiente ecuación permite calcular la capacidad de tamponamiento de una disolución reguladora formada por un ácido débil de constante de acidez Ka y por su base conjugada, en función de las concentraciones de ambos:
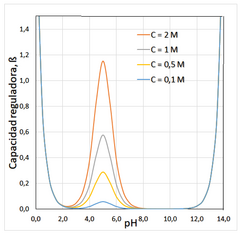
donde CA representa la suma de concentraciones del ácido y su base conjugada implicada en el sistema de tamponamiento. Esta expresión matemática puede representarse gráficamente como una función del pH, con lo que se obtiene un gráfico β=f(pH) del cual se pueden extraer algunas conclusiones:
- Para un sistema HA/A- la capacidad amortiguadora es máxima cuando cuando pH = pKa
- El valor de β es adecuado en el intervalo de pH = pKa ± 1. A variaciones de pH mayores la eficacia del tampón se reduce en más del 66% y a partir de pH = pKa ± 2 la capacidad amortiguadora es insignificante.
- A pH muy ácido o muy básico, β toma valores muy elevados, pues la presencia de ácidos o bases fuertes a altas concentraciones, también producen efectos amortiguadores.
- La capacidad reguladora del tampón depende de la concentración de los componentes.

En el caso de sistemas polipróticos, si las constantes de acidez son muy diferentes (diferencia entre dos pKa consecutivos superior a dos unidades), se aprecian tantas zonas de tamponamiento como pKa tenga el ácido, además de las zonas laterales de regulación por ácido fuerte o base fuerte. Cuando las diferencias entre los pKa es menor de 2 o cuando el ácido es moderadamente débil (pKa < 2) o muy débiles (pka >12) es preciso tener en cuenta la contribución de los diferentes equilibrios y la presencia del ácido fuerte o la base fuerte.
Sistemas tampón fisiológicos[editar]
En la naturaleza, existen muchos sistemas que utilizan estos tampones para regular el pH. Por ejemplo, el sistema tampón bicarbonato se utiliza para regular el pH de la sangre, mientras que dentro de la célula el principal sistema regulador del pH es el tampón fosfato.
Niveles de pH en el cuerpo humano[editar]
Muchas biomoléculas actúan a un determinado valor de pH y sólo toleran fluctuaciones mínimas en él. Dado el bajo grado de ionización del agua (H2O), cuando añadimos en ésta una pequeña cantidad de ácido o de base, el pH varía en un amplio rango, llegando a niveles de pH en los cuales las biomoléculas no podrían cumplir sus funciones. Por esta razón los líquidos fisiológicos contienen tampones que, a diferencia del agua, mantienen el pH constante.
Los tampones mantienen la cantidad de ácidos y de bases en equilibrio en un determinado pH en el cual la actividad biológica de las proteínas, hormonas, enzimas, bombas de iones... sea óptima. En humanos, los valores compatibles con el mantenimiento de funciones vitales son de pH entre 6,8 y 7,8; siendo el intervalo de 7,35 a 7,45 el de normalidad.
En concreto, se puede decir que cada líquido fisiológico tiene un nivel característico normal de pH:
- Sangre arterial: pH = 7,4
- Sangre venosa: pH = 7,35
- Líquido intersticial: pH = 7,35
- Líquido intracelular: pH ∈ [6 , 7,4]
- Orina: pH ∈ [4,5 , 8]
- HCl gástrico: pH = 0,8
Los tampones son los primeros responsables de mantener estos niveles de pH constantes aunque en el organismo se produzcan altas cantidades de ácidos debido al metabolismo. Así, los tampones son el primer nivel de defensa contra los cambios de pH. También contribuyen al equilibrio la regulación respiratoria (segunda línea de defensa) y la regulación renal (tercera línea de defensa).
Cuando hay alteraciones debidas a enfermedades de los riñones, pulmones o por diabetes mellitus, el pH se ve alterado y se padece acidosis (pH < 7,37) o alcalosis (pH > 7,43).
Las causas principales de acidosis son: insuficiencia renal, acidosis tubulorrenal, cetoacidosis diabética, acidosis láctica, sustáncias tóxicas (etilenglicol, salicilato (en sobredosis), metanol, paraldehido, acetazolamida o cloruro de amonio. Las causas principales de alcalosis son: uso de diuréticos (tiacidas, furosemida, ácido etacrínico), pérdida de ácido causada por vómitos o aspiración del contenido del estómago, glándulas suprarrenales hiperactivas (síndrome de Cushing o utilitazación de corticosteroides).
Estas alteraciones pueden rendir su efecto en la primera, la segunda o la tercera línea de defensa; impidiendo así el funcionamiento de todos los mecanismos complejos que mantienen los niveles de pH a niveles adecuados.
Sistemas tampón en el organismo[editar]
Existen tampones de gran importancia en el organismo:
Inorgánicos:
- Tampón bicarbonato:
- Tampón fosfato:
- Orgánicos:
Aminoácidos y proteínas
Tampón hemoglobina:
HHbO2 HbO2- / HbH Hb- + H+
- Aminoácido histidina
Tampón bicarbonato[editar]
Tal y como se ha comentado anteriormente, el tampón bicarbonato está compuesto por ácido carbónico (H2CO3) y bicarbonato (HCO3-) y el valor de su pKa es de 6,1. Es el tampón más importante de la sangre (pH = 7,4), representa el 75 % de la capacidad buffer total de la sangre. También está presente en el líquido intersticial. Es un tampón muy eficaz porque la relación HCO3-/ H2CO3 es muy alta, lo que supone una alta capacidad para amortiguar los ácidos. Supone una ventaja el hecho que se trata de un sistema abierto ya que el CO2 puede ser eliminado en la respiración muy rápidamente, los H+ se pueden eliminar por vía renal y el HCO3- puede reemplazarse en la orina. En realidad, este tampón está compuesto por dos equilibrios, pues el ácido carbónico forma CO2, generando una molécula de H2O.
Cuando el pH disminuye, el bicarbonato toma los protones libres. Así, el equilibrio se desplaza hacia el H2CO3, que a su vez, mediante la reacción catalizada por la anhidrasa carbónica (glóbulos rojos), cede una molécula de H2O y se convierte en CO2, el cual se elimina a través de los pulmones. Por el contrario, si el pH de la sangre aumenta, se forma HCO3- a partir de H2CO3, lo que conduce a mayor captación de CO2. Las concentraciones de HCO3- y de H+ también se pueden controlar por mecanismos fisiológicos a nivel renal. El riñón puede eliminar protones uniéndolos a amoníacos o fosfatos y mantiene la concentración de bicarbonato mediante reabsorción o regeneración del mismo.
La suma de las formas sal y ácido se llama reserva alcalina. En condiciones normales, esta suma tiene el valor 25,2 mEq de CO2 por litro. Como a pH sanguíneo (pH = 7,4), la proporción entre la forma sal y ácido es de 20, resulta que [HCO3-] = 24 mEq/L y [CO2] = 1,2 mEq/L.
Así, es importante tener en cuenta que el cuerpo necesita más bicarbonato que no ácido carbónico porque el metabolismo produce más ácidos que bases.
Tampón fosfato[editar]
El tampón fosfato está compuesto por el hidrógeno fosfato (HPO42-) y el dihidrógeno fosfato (H2PO4-). Actúa en el plasma y el líquido intersticial. Este tampón tiene un pKa de 6,8, el cual está mucho más cerca del pH plasmático. Esto significaría que este tampón tendría que ser más útil que el anterior, pero no es así ya que se encuentra en concentraciones menores en sangre y la eliminación del fosfato es mucho más lenta, por vía renal.
A pH fisiológico de 7,4, la relación HPO4−2/ H2PO4- es igual a 4. Así, se trata de un sistema eficaz para amortiguar ácidos. Como hemos dicho, a nivel sanguíneo, el tampón bicarbonato resulta más útil que el tampón fosfato ya que este último se encuentra en concentraciones bajas. Ahora bien, a nivel intracelular, el tampón fosfato tiene concentraciones elevadas y es más eficiente
Tampón hemoglobina[editar]
La hemoglobina es una proteína globular multimérica que dispone de cuatro puntos de unión a ligandos cuyas propiedades de unión están reguladas alostéricamente. La función principal de la hemoglobina es el transporte de dioxígeno por la sangre.
Referente a su estructura, se trata de un heterotetrámero y consta de dos pares de cadenas polipeptídicas diferentes. Cada una de las cadenas lleva un hemo como grupo prostético, donde se unen las moléculas de O2, por lo que una hemoglobina puede unir como máximo cuatro moléculas de O2.
La captación de O2 se ve afectada, entre otros factores, por los H+ y el CO2. Algunos factores favorecen el estado T, en el cual la proteína no tiene O2 unidos, y otros favorecen el estado R, en el cual la hemoglobina tiene unidas moléculas de O2. Este fenómeno se denomina efecto Bohr. Es muy positivo para remarcar la diferencia entre las distintas afinidades para el O2; la cual es esencial para que cumpla su función de transporte.
Cuando el CO2 forma ácido carbónico y protones, los protones estabilizan el estado T, de descarga de O2. Así, en los capilares periféricos, dónde encontramos CO2, la hemoglobina cede las moléculas de O2. En los capilares de los alvéolos pulmonares se invierte este efecto.
Así, cuando se unen H+ a la hemoglobina, se produce un efecto en el equilibrio del tampón bicarbonato ya que se induce la formación de bicarbonato.
Es un tampón fisiológico muy eficiente gracias al cambio de su pK cuando pasa de la forma oxidada (pK = 7.16) a la reducida (pK = 7.71) y a la gran cantidad que hay en la sangre.
Aminoácidos y proteínas[editar]
Los aminoácidos tienen carácter anfótero, es decir, pueden ceder protones y también captarlos. Esto es así gracias a dos de los radicales iones comunes en todos los aminoácidos: el grupo amino (NH2) y el grupo carboxilo (COOH). Estos radicales, al estar en contacto con el agua, se presentan ionizados o protonados; actuando los dos como donantes o aceptores de protones.
En pH ácidos:
- El NH2 capta un protón: NH3+ (el pKa para este ion es 9)
En pH básicos:
- El COOH pierde un protón: COO- (el pKa para este ion es 2)
En el punto de pKa del grupo amino existe el 50 % de iones amino protonados (NH3+) y el otro 50 % de radicales amino desprotonados (NH2). En este punto, la variación de pH, si adicionamos NaOH a la disolución, es mínima. Por lo tanto, en este punto la capacidad amortiguadora es máxima.
En el punto de pKa para el grupo carboxilo existe el 50 % de iones carboxilo protonados (COOH) y el otro 50 % de iones carboxilo desprotonados (COO-). En este nivel de pH el aminoácido también es buen amortiguador.
En el punto isoeléctrico de los aminoácidos sin cadena radical ácida o básica se encuentra a medio camino entre el pKa del grupo amino y el pKa del grupo carboxilo. Y encontramos el aminoácido en su forma zwitterión, con ambos grupos funcionales ionizados: NH3+ y COO-.
El punto isoeléctrico de los aminoácidos con cadenas protonables es diferente ya que existe un tercer pKa, que corresponde al valor de pH en el cual el protón de la cadena lateral se disocia.
Así, vemos como esta capacidad para captar y ceder protones convierte a las proteínas y aminoácidos en amortiguadores del pH, actuando como ácidos si están protonados, o como bases, si no lo están.
Muchas proteínas tienen grupos protonables en la cadena radical variable, así cada proteína o aminoácido tiene su punto isoeléctrico y su pKa característico para cada grupo protonable del radical variable.
Los pKa pueden verse afectados por radicales próximos y así, puede variar calidad amortiguadora de los aminoácidos según radicales de su entorno. Por ejemplo, la histidina, próxima al grupo hemo en la hemoglobina, tiene pK muy diferentes según si está unida al oxígeno o no.
Cuando los aminoácidos se unen formando péptidos mediante enlaces entre el grupo COOH de un aminoácido y el grupo NH2 de otro, desaparecen sus propiedades amortiguadoras. Ahora bien, siempre existen los grupos terminales y también los grupos ionizables de las cadenas laterales de los aminoácidos: ácido aspártico y glutámico, arginina, lisina, histidina, etc. Así, para determinar su capacidad amortiguadora, solamente observaremos los pK.
Aplicaciones industriales de las disoluciones tampón[editar]
Como hemos visto las disoluciones tampón son muy útiles para el mantenimiento del pH en sistemas biológicos, como por ejemplo el cuerpo humano, pero sus propiedades van mucho más lejos y son ampliamente usadas en las industrias actuales.
- En la industria agrícola, las disoluciones tampón se usan para la fertirrigación y la agricultura hidropónica (cultivar plantas usando disoluciones minerales y no suelo agrícola). Todas las plantas tienen un intervalo de pH en que las raíces absorben nutrientes de forma idónea. Una variación del pH puede afectar al proceso de absorción de las raíces: disminuyendo la captación de minerales y aumentando la permeabilidad a sustancias tóxicas como el aluminio. A su vez, una variación en el pH afecta a la solubilidad de la mayoría de minerales. Existe un pH idóneo para cada planta dependiendo de su fisiología y de los minerales que requiere, pero, como norma general, podemos decir que precisan un pH ligeramente ácido (5,5-7) salvo excepciones como las habas con pH un tanto básico (7,4-8,1)
- En la industria alimentaria también son de gran importancia los parámetros del pH ya que, por ejemplo, nos indica si la carne es apta para el consumo humano. Si la carne está entre 5,4 y 7,0 de pH, es apta para el consumo, pero a lo largo del tiempo el pH disminuye, hecho que indica que su consumo no es pertinente. En la industria vinícola, se deben de tener muy en cuenta las variaciones de pH en la elaboración del vino. Este debe oscilar entre 2,8 y 3,5, puesto que a pH superior a 3,5 determinadas bacterias pueden atacar el vino y producir variaciones en el sabor.
- Es sin duda alguna en la industria farmacéutica en la que se debe tener un control y conocimiento más exhaustivo del pH, por distintas razones:
- Primeramente, para el diseño de los medicamentos es necesario saber el pH de la zona del cuerpo en la que trabajará el fármaco, pues si bajo ese pH las proteínas que queremos usar se desnaturalizan el medicamento no tendrá efecto alguno.
- En el proceso de formulación de los fármacos se usan las propiedades fisicoquímicas del pKa y el pH para elegir la fórmula óptima del medicamento.
- En los ensayos previos a la comercialización de los medicamentos se requiere un control del pH para garantizar que los resultados obtenidos sean reales y ciertos, pues un pH erróneo podría dar resultados falsos.
Referencias[editar]
- ↑ a b Morcillo, Jesús (1989). Temas básicos de química (2.ª edición). Alhambra Universidad. p. 270-272. ISBN 9788420507828.
- ↑ Ayres, Gilbert H. (1974). Análisis Químico Cuantitativo. Ediciones del Castillo. pp. 74-76. ISBN 84-219-0280-6.
- ↑ Scholz, F; Kahlert, H. (2019). «Cap. 3.7 Buffer Solutions». Chemical Equilibria in Analytical Chemistry (en inglés). Suiza: Springer. ISBN 978-3-030-17179-7.
- Werner-Müller 5a edició
- Lubert Stryer – Biochemistry (5a edició). Acid-Base Concepts.
- http://www.ehu.es/biomoleculas/buffers/hh.htm
- https://www.itescam.edu.mx/principal/sylabus/fpdb/recursos/r55275.PDF
- http://es.wikipedia.org/wiki/%C3%81cido_l%C3%A1ctico
- http://www.juntadeandalucia.es/averroes/manuales/materiales_tic/biomoleculas/selectividad/amortiguadores.pdf
- http://www.uco.es/organiza/departamentos/bioquimica-biol-mol/pdfs/06%20pH%20AMORTIGUADORES.pdf
- http://www.biologia.arizona.edu/biochemistry/problem_sets/medph/02t.html
- https://web.archive.org/web/20100420065624/http://todoesquimica.blogia.com/2008/040603-tampon-fosfato.php
Enlaces externos[editar]
- Cálculo del pH de disoluciones amortiguadoras y valoraciones ácido-base con hojas Excel en inglés o portugués.





![{\displaystyle Ka=1,75x10^{-5}={\frac {[CH_{3}COO^{-}][H^{+}]}{[CH_{3}COOH]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7a4c36e1b6015803ae27e07dd8c90e4b0d8f7557)

![{\displaystyle Ka={\frac {[A^{-}][H^{+}]}{[HA]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c7d15a9306345b23d7dbf83d383f549a2e26c5ea)
![{\displaystyle [H^{+}]=Ka\cdot {\frac {[HA]}{[A^{-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/14c3cc83f9f9a96852657e5c427c814a0b947aaa)
![{\displaystyle \log[H^{+}]=logKa+log{\frac {[HA]}{[A^{-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1e973b489add4fe1eab717836fba3633a780e65d)
![{\displaystyle -\log[H^{+}]=-logKa-log{\frac {[HA]}{[A^{-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/332928df0aca4dfdd8a47e4e6191f4625bae22a4)
![{\displaystyle pH=pKa+log{\frac {[A^{-}]}{[HA]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ea825f142cda73c334ac9427d4b29ba2be8352c2)








![{\displaystyle \beta =2,303{\biggl (}[H^{+}]+{\frac {Kw}{[OH^{-}]}}+{\frac {C_{A}Ka[H^{+}]}{{\bigl (}Ka+[H^{+}]{\bigr )}^{2}}}{\biggr )}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/187fb5c4abaa793ecca53c4d1122d5ad83f5260d)



![{\displaystyle {\begin{array}{c}\\{\mathsf {CO_{2}\ {\ce {<->}}\ CO_{2}\ {\ce {<->[+H_2O][-H_2O]}}\ H_{2}CO_{3}\ {\ce {<->}}\ HCO_{3}^{-}\ +\ H^{+}}}\end{array}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1ee8f0eb771b797c0d834f438c672ac49cd957cd)
