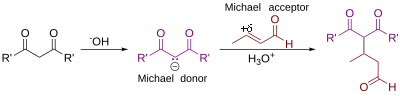
Reacción de Michael
La reacción de Michael o adición de Michael consiste en una adición nucleófila de un carbanión a un compuesto carbonílico α,β-insaturado. Pertenece a la clase más grande de las adiciones conjugadas. Es uno de los métodos más útiles de formación de enlaces C-C en condiciones suaves. Existen muchas variantes asimétricas.[1][2]
En este esquema los sustituyentes R y R' en el nucleófilo son grupos electroaceptores tales como los acilo y ciano convirtiendo al hidrógeno metilénico en ácido, que al reaccionar con la base B: da lugar al carbanión. El sustituyente en el alqueno activado es normalmente una cetona, lo que la convierte en una enona, pero puede ser también un grupo nitro.
Definición
Tal como fue definida originalmente por Michael,[3] la reacción es una adición de un enolato de una cetona o aldehído sobre el carbono β de un compuesto carbonílico α,β-insaturado (el "aceptor" de Michael). Una definición posterior, propuesta por Kohler,[4] es la adición 1,4 de un carbono nucleófilo doblemente estabilizado a un compuesto carbonílico α,β-insaturado. Algunos ejemplos de nucleófilos incluyen a beta-cetoesteres, malonatos y beta-cianoesteres. El producto resultante contiene un altamente útil patrón de dos carbonilos (C=O) en 1,5.
Mecanismo
El mecanismo de reacción es esbozado a continuación con un compuesto 1,3-dicarbonilo 1, (siendo p.ej. R un residuo alcoxi), como nucleófilo:
La desprotonación de 1 por la base conduce al carbanión 2 estabilizado por sus grupos electroaceptores. Las estructuras 2A, 2B y 2C son tres estructuras de resonancia que pueden ser dibujadas para esta especie, dos de las cuales son iones enolato (2B y 2C). Este nucleófilo reacciona con el alqueno eletrofílico 3 dando 4 en una reacción de adición conjugada. La abstracción del protón de la base protonada (o del solvente) por el enolato conduce al producto 5, siendo este el paso final.
Referencias
- ↑ http://www.chem.ucalgary.ca/courses/351/Carey5th/Ch18/ch18-4-3.html.
- ↑ Clayden et al, Organic Chemistry
- ↑ Michael, Arthur. J. Prakt. Chem. 1887, 36, 349-356; ibid.,1894, 49, 20
- ↑ Kohler. (J. Am. Chem. Soc., 1907, 37, 385; ibid., 1935, 57, 1316.
Bibliografía
- K. Peter C. Vollhardt (1994). Química Orgánica. Barcelona: Ediciones Omega S.A. ISBN 84-282-0882-4.
- W.R. Peterson (1996). Formulación y nomenclatura química orgánica. Barcelona: EDUNSA - Ediciones y distribuciones universitarias S.A. ISBN 84-85257-03-0.