Imatinib
| Imatinib | ||
|---|---|---|
 | ||
| Nombre (IUPAC) sistemático | ||
| 4-[(4-methylpiperazin-1-yl)methyl]-N-[4-methyl-3-[(4-pyridin-3-ylpyrimidin-2-yl)amino]phenyl]benzamide | ||
| Identificadores | ||
| Número CAS | 152459-95-5 | |
| Código ATC | L01XE01 | |
| PubChem | 5291 | |
| Datos químicos | ||
| Fórmula | C29H31N7O | |
| Peso mol. | 493.603 g/mol | |
| Farmacocinética | ||
| Biodisponibilidad | 98% | |
| Unión proteica | 95% | |
| Metabolismo | Hepático | |
| Vida media | 18 horas | |
| Excreción | Fecal (68%) y renal (13%) | |
| Datos clínicos | ||
| Cat. embarazo | D | |
| Estado legal | Solo Rx | |
| Vías de adm. | Oral / Endovenosa | |
El imatinib es un medicamento de terapia dirigida en presentación oral usado para tratar ciertos tipos de cáncer.[1] Es actualmente comercializado por Novartis bajo el nombre de Gleevec (EE. UU.) o Glivec (Europa/Australia) como su sal mesilato, mesilato de imatinib (DCI, nombre formal: STI-571). Específicamente, se emplea en el tratamiento de leucemia mieloide crónica (LMC) y la leucemia linfocítica aguda (LLA) con cromosoma Filadelfia positivo (Ph +), ciertos tipos de tumores del estroma gastrointestinal (GISTs), síndrome hipereosinofílico (HES), leucemia eosinofílica crónica (CEL), mastocitosis sistémica y síndrome mielodisplásico.[2]
Es el primer miembro de una nueva clase de medicamentos denominados inhibidores de la tirosina quinasa, que actúan por medio de la inhibición específica del compuesto tirosina quinasa, que se libera como característica particular de un tipo de célula cancerosa. En la leucemia mieloide crónica, por ejemplo, existe una mutación a nivel del cromosoma 9 en el gen Bcr-abl (una translocación).[3] Este gen codifica una clase de tirosina quinasa que se encuentra activada en forma permanente siendo causa de múltiples trastornos, entre ellos mieloproliferación. El Imatinib se une a los sitios activos de la tirosina quinasa y previene de esta forma su actividad enzimática y corrige la evolución de la enfermedad.
Algunos de los efectos secundarios comunes incluyen vómitos, diarrea, dolor muscular, dolor de cabeza y sarpullido. Entre los efectos secundarios de mayor seriedad se pueden incluir retención de líquidos, hemorragia gastrointestinal, supresión de la médula ósea, problemas hepáticos e insuficiencia cardíaca . El uso durante el embarazo puede provocar daños al bebé.
Historia[editar]
El imatinib fue desarrollado a finales de la década de los noventa por el químico Nicholas B. Lydon, el oncólogo Brian J. Druker de la Oregon Health and Science University y Charles L. Sawyers del Memorial Sloan-Kettering Cancer Center,[4] los cuales iniciaron los ensayos clínicos confirmando su eficacia contra la leucemia mieloide crónica.
Su desarrollo es un ejemplo de diseño racional de medicamentos. Poco después de la identificación del bcr-abl como blanco de tratamiento farmacológico, se inició la búsqueda de un inhibidor. Los químicos usaron un método de screening de alto volumen de datos (en inglés "High-throughput screening") de archivos de compuestos químicos, hasta identificar la molécula 2-fenilaminopirimidina. Este fue el compuesto inicial que fue probado y modificado con la introducción de los grupos metil y benzamida para proporcionarle un incremento a su capacidad de adherencia al imatinib.[5]
El Glivec recibió aprobación de la Food and Drug Administration estadounidense en mayo de 2001. En el mismo mes se publicitó en la revista Time como la «bala mágica» para curar el cáncer.
En el año 2020 se aprobó el primer medicamento con imatinib para uso veterinario (Oncovet I), de Laboratorio Chemovet (Argentina). En medicina veterinaria esta indicado para el tratamiento de pacientes caninos y felinos con cáncer tales como mastocitomas, fibrosarcomas, tumores del estroma gastrointestinal, hemangiosarcomas, leucemia de células B, meningiomas, sarcomas asociados a vacunas y síndrome hipereosinofílico en felinos. También en hipertensión arterial pulmonar en caninos.
Usos[editar]
El imatinib es usado en la leucemia mieloide crónica (LMC), tumores del estroma gastrointestinal (GISTs), síndromes mieloproliferativos, leucemia linfoblástica aguda, síndrome hipereosinofílico o leucemia eosinofílica crónica y otras patologías malignas. Un estudio demostró que el mesilato de imatinib era efectivo en pacientes con mastocitosis sistémica, excepto aquellas que tenían la mutación D816V en c-Kit, pero los enfermos con la referida mutación constituyen cerca del 90% de los casos de mastocitosis.[6] Estudios clínicos iniciales también mostraron su potencial para el tratamiento del dermatofibrosarcoma protuberans.
En el laboratorio, el imatinib está siendo usado como un agente experimental para supresión del factor de crecimiento derivado de plaquetas (PDGF) por medio de la inhibición de su receptor (PDGF-Rβ). Uno de sus efectos es la demora en la aparición de aterosclerosis en ratones con diabetes.[7]
Estudios animales recientes en ratones en la Universidad de Emory en Atlanta han sugerido que el Imatinib y los medicamentos relacionados podrían ser usados en el tratamiento de la viruela, en caso de que una epidemia ocurriera,[8] mientras que otros estudios intentan descubrir si el imatinib puede tener un efecto beneficioso en el tratamiento de la fibrosis pulmonar.[9]
En medicina veterinaria esta indicado para el tratamiento de pacientes caninos y felinos con cáncer tales como mastocitosis, fibrosarcomas, tumores del estroma gastrointestinal, angiosarcomas, leucemia de células B, meningiomas, sarcomas asociados a vacunas y síndrome hipereosinofílico en felinos. También en hipertensión pulmonar en caninos.[10]
Tolerancia y efectos adversos[editar]

En Estados Unidos, la FDA aprobó el imatinib como tratamiento de primera línea para LMC Ph+.[11] El imatinib ha superado la fase III en estudios para la LMC, y ha demostrado ser más efectivo que el tratamiento estándar anterior con α-interferón y citarabina. Sin embargo los efectos adversos a largo plazo (dado que la medicación debe tomarse en forma crónica), aún permanecen en estudio. Los investigadores sugieren que es habitualmente bien tolerado; se dispone de escasa información sobre niños, niñas, mujeres embarazadas y efectos sobre la gestación y el feto. En general, efectos adversos tales como edema, náusea, y dolor músculo-esquelético son comunes pero leves.
La insuficiencia cardíaca congestiva severa es un efecto adverso poco común pero reconocido del imatinib; los ratones tratados con dosis elevada muestran daño por toxicidad en el miocardio.[12]
Farmacología[editar]
Farmacocinética[editar]
El Imatinib es rápidamente absorbido al ser administrado por vía oral, y posee una muy elevada biodisponibilidad: el 98% de una dosis oral alcanza el torrente sanguíneo. El Metabolismo del imatinib ocurre en el hígado y es mediado por algunas isozimas del sistema citocromo P450, incluyendo CYP3A4 y, en menor cantidad, CYP1A2, CYP2D6, CYP2C9, y CYP2C19. El principal metabolito derivado, N-demetil piperazina, es también activo. La principal vía de eliminación es biliar y fecal; solo una pequeña fracción de la droga es excretada en la orina. La mayor parte del imatinib es eliminado como metabolitos, solo el 25% es eliminado sin cambios. La vida media del imatinib y su principal metabolito es de 18 y 40 horas, respectivamente...
Mecanismo de acción[editar]
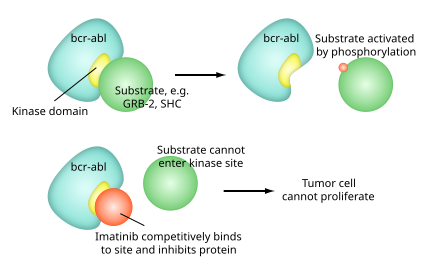
El Imatinib es un derivado de 2-Fenilaminopirimidina que funciona como un inhibidor específico de una cantidad de enzimas tirosina quinasa. Esta ocupa el sitio activo TK, iniciando una disminución en su actividad. Imatinib es un inhibidor de molécula pequeña que se dirige a múltiples tirosina quinasas como CSF1R, ABL, c-KIT, FLT3 y PDGFR-β . [13] [14]
Existe un gran número de enzimas TK en el cuerpo, incluyendo los receptores de insulina. El Imatinib es específico para el dominio TK en el cromosoma filadelfia abl (del inglés the Abelson proto-oncogene), c-kit y el receptor (FCDP-R) (factor de crecimiento derivado de plaquetas).
En la leucemia mieloide crónica, el cromosoma Filadelfia produce una fusión proteica de abl con bcr (breakpoint cluster region), llamada bcr-abl. Con ello se altera la síntesis proteica y se produce una tirosina quinasa activa continuamente. El imatinib es usado para disminuir la actividad de la tirosina quinasa producida por la traslocación bcr-abl.
Cada uno de los sitios activos de la tirosina quinasa tienen un sitio de unión para el ATP. La actividad enzimática catalizada por una tirosina quinasa es la transferencia del terminal fosfato desde el ATP a los residuos de tirosina en sus substratos, un proceso conocido como fosforilación proteica de la tirosina. El imatinib actúa mediante la unión al mismo sitio que el ATP de la tirosina quinasa alterada e inhibiendo la actividad enzimática de la proteína en forma competitiva.[15]
El imatinib es completamente selectivo para bcr-abl –esto hace que también inhiba otros blancos mencionado previamente (c-kit and PDGF-R), pero no otras tirosina quinasas conocidas. El imatinib también inhibe la proteína abl de células no cancerígenas pero estas células normalmente tienen tirosina quinasas redundantes adicionales las cuales permiten continuar la función aun si la tirosina quinasa abl es inhibida. Algunas células tumorales, sin embargo tienen una dependencia de bcr-abl.[11] La inhibición de la tirosina quinasa bcr-abl también estimula su entrada dentro de núcleo, donde es incapaz de llevar a cabo cualquiera de sus funciones normales como anti-apoptotico.[16]
Aspectos económicos y patentes[editar]

El Glivec ha sido utilizado como caso de estudio sobre el alto precio de los medicamentos anticancerígenos.[17] El precio de una tableta varía según cada país. En 2013 en Estados Unidos el tratamiento costaba 90.000 dólares al año mientras que en España costaba 30.000 euros al año (unos 45.000$, aproximadamente la mitad que en EE. UU).[17]
En 2007, Novartis utilizó el ejemplo del imatinib para tratar de invalidar parte de la legislación sobre patentes de la India, país en el que se encuentran muchos fabricantes de medicamentos genéricos. Médicos sin fronteras y otras ONG alegan que un cambio en la legislación podría hacer imposible para las compañías indias producir medicamentos antirretrovirales genéricos baratos, haciendo imposible para los países del tercer mundo adquirir estos medicamentos esenciales de la OMS.[18][19] El 6 de agosto de 2007 el alto tribunal de Madrás (India) desestimó la demanda judicial emprendida por Novartis, confirmando la constitucionalidad de la Sección 3(d) de la Ley de Patentes India y difirió el caso al foro de la Organización Mundial del Comercio (OMC) para resolver la cuestión.
El 1 de abril de 2013 el Tribunal Supremo de la India dictó sentencia sobre la solicitud que mantiene Novartis desde 2006 por la patente de Glivec o Gleevec, rechazando dicha patente. De esta manera, los fabricantes de medicamentos genéricos de ese país pueden fabricar legalmente el principio activo.[20] Se espera que ello reduzca el precio del medicamento a una décima parte.[17]
En un análisis presentado en el panel de Alto Nivel del Secretario General de las Naciones Unidas sobre el Acceso a los Medicamentos, el investigador Andrew Hill[21] aseguró que este medicamento tiene un coste de fabricación muy bajo (de 128 a 216 dólares anuales) pero la farmacéutica Novartis, comercializado en Estados Unidos con el nombre de Gleevec, lo vende a 108.000 dólares anuales. En España el coste del tratamiento anual ronda los 30.000 euros, según la información recopilada por Médicos del Mundo.[22][23][24]
En Estados Unidos la farmacéutica Cost Plus Drugs vende un genérico del medicamento, Imatinib, por un precio 99 % inferior.[25][26]
Véase también[editar]
- Historia de la Quimioterapia
- Ibrutinib
Referencias[editar]
- ↑ «Imatinib Monograph for Professionals». Drugs.com (en inglés). Consultado el 9 de julio de 2021.
- ↑ Jaeckle, Kurt A.; Anderson, S. K.; Twohy, Erin L.; Dixon, Jesse G.; Giannini, Caterina; Jenkins, Robert; Egorin, Merrill J.; Sarkaria, Jann N. et al. (2019-07). «Phase I-II trial of imatinib mesylate (Gleevec; STI571) in treatment of recurrent oligodendroglioma and mixed oligoastrocytoma. North central cancer treatment group study N0272 (ALLIANCE/NCCTG)». Journal of Neuro-Oncology (en inglés) 143 (3): 573-581. ISSN 0167-594X. PMC 6717651. PMID 31119479. doi:10.1007/s11060-019-03194-z. Consultado el 9 de julio de 2021.
- ↑ «¿Qué causa la leucemia mieloide crónica?». www.cancer.org. Consultado el 9 de julio de 2021.
- ↑ A Conversation With Brian J. Druker, M.D., Researcher Behind the Drug Gleevec, By CLAUDIA DREIFUS, New York Times, November 2, 2009
- ↑ Druker BJ, Lydon NB. Lessons learned from the development of an Abl tyrosine kinase inhibitor for chronic myelogenous leukemia. J Clin Invest 2000;105:3-7. PMID 10619854
- ↑ Droogendijk HJ, Kluin-Nelemans HJ, van Doormaal JJ, Oranje AP, van de Loosdrecht AA, van Daele PL. Imatinib mesylate in the treatment of systemic mastocytosis: a phase II trial. Cancer. 2006 Jul 15;107(2):345-51. PMID 16779792
- ↑ Lassila M, Allen TJ, Cao Z, Thallas V, Jandeleit-Dahm KA, Candido R, Cooper ME. Imatinib attenuates diabetes-associated atherosclerosis. Arterioscler Thromb Vasc Biol 2004;24:935-42. PMID 14988091
- ↑ Reeves P, Bommarius B, Lebeis S, McNulty S, Christensen J, Swimm A, Chahroudi A, Chavan R, Feinberg M, Veach D, Bornmann W, Sherman M, Kalman D (2005). Disabling poxvirus pathogenesis by inhibition of Abl-family tyrosine kinases. Nat Med 11 (7): 731-9. PMID 15980865
- ↑ Rondón, Carlos (19 de diciembre de 2011). «Efectos del Imatinib en la fibrosis pulmonar». Consultado el 20 de diciembre de 2011.
- ↑ «ONCOVET I - CHEMOVET». Vademecum Sani. Consultado el 11 de marzo de 2024.
- ↑ a b Deininger M, Druker BJ. Specific Targeted Therapy of Chronic Myelogenous Leukemia with Imatinib. Pharmacol Rev 2003;55:401-423. PMID 12869662.
- ↑ Risto Kerkelä, Luanda Grazette, Rinat Yacobi, et al.. «Cardiotoxicity of the cancer therapeutic agent imatinib mesylate». Nature Med 12: 908-16.
- ↑ Green KN, Crapser JD, Hohsfield LA (September 2020). «To Kill a Microglia: A Case for CSF1R Inhibitors». Trends in Immunology 41 (9): 771-784. PMC 7484341. PMID 32792173. doi:10.1016/j.it.2020.07.001.
- ↑ Mun SH, Park PS, Park-Min KH (August 2020). «The M-CSF receptor in osteoclasts and beyond». Experimental & Molecular Medicine 52 (8): 1239-1254. PMC 8080670. PMID 32801364. doi:10.1038/s12276-020-0484-z.
- ↑ Takimoto CH, Calvo E. "Principles of Oncologic Pharmacotherapy" Archivado el 15 de mayo de 2009 en Wayback Machine. in Pazdur R, Wagman LD, Camphausen KA, Hoskins WJ (Eds) Cancer Management: A Multidisciplinary Approach Archivado el 4 de octubre de 2013 en Wayback Machine.. 11 ed. 2008.
- ↑ Vigneri P, Wang JY. Induction of apoptosis in chronic myelogenous leukemia cells through nuclear entrapment of BCR-ABL tyrosine kinase. Nat Med 2001:7:228-234. PMID 11175855
- ↑ a b c Prats, Jaime (26 de abril de 2013). «120 expertos mundiales alertan del precio de las terapias contra el cáncer». El País. Consultado el 6 de mayo de 2013.
- ↑ Médecins Sans Frontières. "As Novartis Challenges India's Patent Law, MSF Warns Access to Medicines Is Under Threat" Archivado el 24 de febrero de 2008 en Wayback Machine., 26 de septiembre de 2006. Consultado el 10 de febrero de 2006.
- ↑ «Lista de Medicamentos esenciales OMS» (PDF). Consultado el 9 de julio de 2021.
- ↑ India deniega la patente del Glivec a Novartis publicado por Europa Press el 1 de abril de 2013. Comprobado el 1 de abril de 2013.
- ↑ Andrew Hill, Research Gate, Universidad de Liverpool
- ↑ La burbuja del precio de los medicamentos para el cáncer, eldiario.es, Laura Galaup, junio de 2017
- ↑ UK NHS cancer patients denied drugs due to inflated prices – experts, The Guardian, 23 de septiembre de 2015
- ↑ 1000-fold mark-up for drug prices in high-income countries blocks access to HIV, HCV and cancer drugs, i-base, 29 de noviembre de 2016
- ↑ Jenei, Kristina; Lythgoe, Mark P.; Prasad, Vinay (1 de septiembre de 2022). «CostPlus and implications for generic imatinib». The Lancet Regional Health - Americas 13: 100317. ISSN 2667-193X. doi:10.1016/j.lana.2022.100317. Consultado el 28 de septiembre de 2023.
- ↑ «Medications Details | Mark Cuban Cost Plus Drug Company». costplusdrugs.com. Consultado el 28 de septiembre de 2023.
