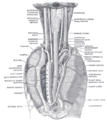
Ganglio cervical superior
| Ganglio cervical superior | ||
|---|---|---|
 Diagrama del Glanglio cervical superior. (Etiquetado como "Upper cervical ganglion") | ||
| TA | A14.3.01.009 | |
El ganglio cervical superior ( SCG por sus siglas en inglés) es parte del sistema nervioso autónomo (SNA), más específicamente es parte del sistema nervioso simpático, una división del SNA que se asocia más comúnmente con la respuesta de lucha o huida. El SNA se compone de vías que conducen hacia y desde los ganglios, grupos de células nerviosas. Un ganglio permite una gran cantidad de divergencia en una vía neuronal y también permite un circuito más localizado para el control de los objetivos inervados.[1] El SCG es el único ganglio en el sistema nervioso simpático que inerva la cabeza y el cuello. Es el más grande y más rostral (superior) de los tres ganglios cervicales. El SCG inerva muchos órganos, glándulas y partes del sistema carotídeo de la cabeza.
Estructura[editar]
Ubicación[editar]
El SCG está ubicado frente a la segunda y tercera vértebras cervicales. Se encuentra profundamente en la vaina de la arteria carótida interna y la vena yugular interna, y anterior al músculo largo de la cabeza. El SCG contiene neuronas que suministran inervación simpática a varios órganos diana dentro de la cabeza.
El SCG también contribuye al plexo cervical . El plexo cervical se forma a partir de una unificación de las divisiones anteriores de los cuatro nervios cervicales superiores. Cada uno recibe un ramo comunicante gris desde el ganglio cervical superior del tronco simpático.[2]
Morfología y fisiología y sus neuronas.[editar]
El ganglio cervical superior es de color gris rojizo, y suele tener la forma de una pelota de fútbol con extremos cónicos. A veces, el SCG es amplio y aplanado, y ocasionalmente se contrae a intervalos. Se formó por la fusión de cuatro ganglios, correspondientes a los cuatro nervios cervicales superiores, C1-C4. Los cuerpos de estas neuronas simpáticas preganglionares se encuentran específicamente en el asta lateral de la médula espinal. Estas neuronas preganglionares luego entran al SCG y hacen sinapsis con las neuronas posganglionares que salen del extremo rostral del SCG e inervan los órganos diana de la cabeza.
Hay varios tipos de neuronas en el SCG que van desde las de umbral bajo hasta las neuronas de umbral alto. Las neuronas con un umbral bajo tienen una velocidad de disparo potencial de acción más rápida, mientras que las neuronas de umbral alto tienen una velocidad de disparo lenta.[3] Otra distinción entre los tipos de neuronas del SCG se realiza mediante inmunotinción. La inmunotinción permite clasificar las neuronas del SCG como positivas o negativas para el neuropéptido Y (NPY), que se encuentra en un subgrupo de neuronas de alto umbral. Las neuronas de bajo umbral, NPY-negativas son neuronas secretomotoras, que inervan las glándulas salivales. Las neuronas de umbral alto, NPY-negativas son neuronas vasomotoras que inervan los vasos sanguíneos. Las neuronas de umbral alto positivas para NPY son neuronas vasoconstrictoras, que inervan el iris y la glándula pineal.
Inervación[editar]
El SCG recibe información del centro ciliospinal. El centro ciliospinal se encuentra entre las regiones C8 y T1 de la médula espinal dentro de la columna intermediolateral. Las fibras preganglionares que inervan el SCG son los nervios espinales torácicos, que se extienden desde la región T1-T8 del centro ciliospinal. Estos nervios entran en el SCG a través del nervio simpático cervical. Un axón preganglionar maduro puede inervar entre 50 y 200 células SCG.[4] Las fibras posganglionares salen del SCG a través del nervio carotídeo interno y el nervio carótido externo. Esta vía de inervación del SCG se muestra a través de la estimulación del nervio simpático cervical, que invoca potenciales de acción tanto en los nervios carótidos internos como externos.[5] Estas fibras postganglionares pasan de la inervación de axones múltiples de sus objetivos a una inervación de axones múltiples menos profunda o a una inervación de un solo axón a medida que las neuronas del SCG maduran durante el desarrollo postnatal.[6]
Función[editar]
Sistema nervioso simpático[editar]
El SCG proporciona inervación simpática a las estructuras internas de la cabeza, incluida la glándula pineal, los vasos sanguíneos en los músculos craneales y el cerebro, el plexo coroideo, los ojos, las glándulas lagrimales, el cuerpo carotídeo, las glándulas salivales y la glándula tiroides.[1]
Glándula pineal[editar]
Los axones posganglionares del SCG inervan la glándula pineal y están involucrados en el ritmo circadiano.[7] Esta conexión regula la producción de la hormona melatonina, que regula los ciclos de sueño y vigilia, sin embargo, la influencia de la inervación por las neuronas del SCG de la glándula pineal no es comprendida completamente.[8]
Cuerpo carotídeo[editar]
Los axones posganglionares del SCG inervan la arteria carótida interna y forman el plexo carotídeo interno. El plexo carotídeo interno transporta los axones posganglionares del SCG al ojo, la glándula lagrimal, las membranas mucosas de la boca, la nariz y la faringe, y a numerosos vasos sanguíneos en la cabeza.
El ojo[editar]
Los axones posganglionares del ganglio cervical superior inervan el ojo y la glándula lagrimal y causan vasoconstricción del iris y la esclerótica, dilatación pupilar, ensanchamiento de la fisura palpebral y la producción reducida de lágrimas.[9] Estas respuestas son importantes durante la respuesta de lucha o huida del SNA. La dilatación de las pupilas permite una mayor claridad en la visión, y la inhibición de la glándula lagrimal detiene la producción de lágrimas, permitiendo una visión sin impedimentos y la redirección de la energía a otro lugar.
Vasos sanguíneos de la piel[editar]
Los axones postganglionares del SCG inervan los vasos sanguíneos de la piel y hacen que los vasos se contraigan. La constricción de los vasos sanguíneos causa una disminución del flujo de sangre a la piel, lo que lleva a la palidez de la piel y a la retención del calor corporal. Esto juega un papel importante en la respuesta de lucha o huida, disminuyendo el flujo de sangre a la piel del rostro y redirigiendo la sangre a áreas más importantes como los vasos sanguíneos de los músculos.
Sistema vestibular[editar]
El SCG está conectado con las estructuras vestibulares, incluyendo el neuroepitelio de los canales semicirculares y los órganos del otolito, proporcionando un sustrato concebible para la modulación de los reflejos vestíbulo-simpáticos.
Significación clínica[editar]
Síndrome de Horner[editar]
El síndrome de Horner es un desorden resultante del daño a la vía nerviosa autonómica simpática de la cabeza. El daño al SCG, parte de este sistema, a menudo resulta en el síndrome de Horner. El daño a las regiones T1-T3 de la médula espinal es responsable de la caída de los párpados ( ptosis ), la constricción de la pupila ( miosis ) y el hundimiento del globo ocular ( enoftalmia aparente; globo ocular no realmente hundido, solo aparece así debido a la caída del párpado).[7] La lesión o daño significativo al SCG produce un trastorno neuronal de tercer orden (ver Síndrome de Horner: Fisiopatología ).
Disautonomía familiar[editar]
La disautonomía familiar es un trastorno genético caracterizado por anormalías en las neuronas sensoriales y simpáticas. El SCG se ve significativamente afectado por esta pérdida de neuronas y puede ser responsable de algunos de los síntomas resultantes. En estudios post mortem, el SCG es, en promedio, un tercio del tamaño normal y tiene solo el 12 por ciento del número normal de neuronas.[10] Los defectos en la codificación genética del factor de crecimiento nervioso FCN, que resultan en un FCN menos funcional y anormalmente estructurado, pueden ser la causa molecular de la disautonomía familiar.[11] El FCN es necesario para la supervivencia de algunas neuronas, así que la pérdida de la función FCN podría ser la causa de la muerte neuronal en el SCG.
Historia[editar]
Reinervación[editar]
A finales del siglo XIX, John Langley descubrió que el ganglio cervical superior está organizado topográficamente. Cuando se estimulaban ciertas áreas del ganglio cervical superior, se producía un reflejo en regiones específicas de la cabeza. Sus hallazgos mostraron que las neuronas preganglionares inervan neuronas postganglionares específicas.[6][12] En sus estudios posteriores sobre el ganglio cervical superior, Langley descubrió que el ganglio cervical superior es regenerativo. Langley cortó el SCG por encima de la porción T1, causando una pérdida de reflejos. Langley cortó el SCG por encima de la porción T1, causando una pérdida de reflejos. Cuando se dejaron por su propia cuenta, las fibras reinervaron el SCG y los reflejos autonómicos iniciales se recuperaron, aunque la recuperación de la función de la glándula pineal fue limitada.[13] Cuando Langley cortó las conexiones entre el SCG y la región T1-T5 de la médula espinal y reemplazó el SCG por otro diferente, el SCG seguía inervado en la misma porción de la médula espinal que antes. Cuando reemplazó el SCG con un ganglio T5, el ganglio tendió a ser inervado por la porción posterior de la médula espinal (T4-T8). El reemplazo del SCG original con uno diferente o un ganglio T5 apoyó la teoría de Langley de la especificidad topográfica del SCG.
Investigación[editar]
Los ganglios del sistema nervioso autónomo periférico se usan comúnmente para estudiar las conexiones sinápticas. Estos ganglios se estudian ya que las conexiones sinápticas muestran muchas similitudes con el sistema nervioso central (SNC) y también son relativamente accesibles. Son más fáciles de estudiar que el SNC, ya que tienen la capacidad de volver a crecer, que las neuronas del SNC no tienen. El SCG se usa con frecuencia en estos estudios, ya que es uno de los ganglios más grandes.[14] Hoy en día, los neurocientíficos están estudiando temas sobre el SCG como la supervivencia y el crecimiento de las neuronas del SCG, los aspectos neuroendocrinos del SCG, y la estructura y las vías del SCG. Estos estudios se realizan normalmente en ratas, conejillos de indias y conejos.
Contribuciones históricas[editar]
- E. Rubin estudió el desarrollo del SCG en ratas fetales.[15] La investigación sobre el desarrollo de los nervios en el SCG tiene implicaciones para el desarrollo general del sistema nervioso.
- Los efectos de la edad en la arborización dendrítica de las neuronas simpáticas se ha estudiado en el SCG de las ratas. Los hallazgos han demostrado que hay un crecimiento dendrítico significativo en el SCG de las ratas jóvenes pero ninguno en las ratas de edad. En ratas de edad, se encontró que había una reducción en el número de dendritas.[16]
- Las células SCG se utilizaron para estudiar el factor de crecimiento nervioso (NGF) y su capacidad para dirigir el crecimiento de las neuronas. Los resultados mostraron que el NGF tenía este efecto de dirección, o trópico, en las neuronas, guiando la dirección de su crecimiento.[17]
Imágenes adicionales[editar]
-
La cadena simpática derecha y sus conexiones con los plexos torácico, abdominal y pélvico.
-
Ganglio cervical superior
-
Conexiones simpáticas de los ganglios ciliares y cervicales superiores.
-
La posición y relación del esófago en la región cervical y en el mediastino posterior. Visto desde atrás.
-
La inervación del Tronco Simpático y el SCG de los órganos objetivo en la cabeza.
Referencias[editar]
Este artículo incorpora texto de dominio público de la página 978 de la 20.ª edición de Gray's Anatomy (1918)
- ↑ a b Michael J. Zigmond, ed. (2000). Fundamental neuroscience (2 edición). San Diego: Acad. Press. pp. 1028–1032. ISBN 0127808701.
- ↑ Henry Gray.
- ↑ Li, Chen; Horn, John P. (2005). «Physiological classification of sympathetic neurons in the rat superior cervical ganglion». Journal of Neurophysiology 95 (1): 187-195. PMID 16177176. doi:10.1152/jn.00779.2005.
- ↑ Purves, D; Wigston, DJ (January 1983). «Neural units in the superior cervical ganglion of the guinea-pig.». The Journal of Physiology 334 (1): 169-78. PMC 1197307. PMID 6864556. doi:10.1113/jphysiol.1983.sp014487.
- ↑ Purnyn, H..; Rikhalsky, O.; Fedulova, S.; Veslovsky, N. (2007). «Transmission Pathways in the Rat Superior Cervical Ganglion». Neurophysiology 39 (4–5): 396-399. doi:10.1007/s11062-007-0053-2.
- ↑ a b Purves, Dale; Lichtman, Jeff W. (2000). Development of the Nervous System. Sunderland, Mass.: Sinauer Associates. pp. 236–238. ISBN 0878937447.
- ↑ a b Purves, Dale (2012). Neuroscience (5 edición). Sunderland, Mass.: Sinauer. p. 465. ISBN 9780878936953.
- ↑ Photoperiodism, melatonin, and the pineal. London: Pitman Publishing Ltd. 2009. p. 14.
- ↑ Lichtman, Jeff W.; Purves, Dale; Yip, Joseph W. (1979). «On the purpose of selective innervation of guinea-pig superior cervical ganglion cells». Journal of Physiology 292 (1): 69-84. PMC 1280846. PMID 490406. doi:10.1113/jphysiol.1979.sp012839.
- ↑ Pearson, J; Brandeis, L; Goldstein, M (5 de octubre de 1979). «Tyrosine hydroxylase immunoreactivity in familial dysautonomia». Science 206 (4414): 71-72. Bibcode:1979Sci...206...71P. PMID 39339. doi:10.1126/science.39339.
- ↑ Schwartz, JP; Breakefield, XO (February 1980). «Altered nerve growth factor in fibroblasts from patients with familial dysautonomia.». Proceedings of the National Academy of Sciences of the United States of America 77 (2): 1154-8. Bibcode:1980PNAS...77.1154S. PMC 348443. PMID 6244581. doi:10.1073/pnas.77.2.1154.
- ↑ Sanes, Dan H.; Reh, Thomas A.; Harris, William A. (1985). Principles of neural development. San Diego, CA: Academic Press. pp. 214-221. ISBN 0-12-300330-X.
- ↑ Lingappa, Jaisri R.; Zigmond, Richard E. (2013). «Limited Recovery of Pineal Function after Regeneration of Preganglionic Sympathetic Axons:Evidence for Loss of Ganglionic Synaptic Specificity». The Journal of Neuroscience 33 (11): 4867-4874. PMC 3640627. PMID 23486957. doi:10.1523/JNEUROSCI.3829-12.2013.
- ↑ Purves, D; Lichtman, JW (October 1978). «Formation and maintenance of synaptic connections in autonomic ganglia.». Physiological Reviews 58 (4): 821-62. PMID 360252. doi:10.1152/physrev.1978.58.4.821.
- ↑ Rubin, E (March 1985). «Development of the rat superior cervical ganglion: ganglion cell maturation.». The Journal of Neuroscience 5 (3): 673-84. PMC 6565020. PMID 2983044. doi:10.1523/jneurosci.05-03-00673.1985.
- ↑ Andrews, TJ; Li, D; Halliwell, J; Cowen, T (February 1994). «The effect of age on dendrites in the rat superior cervical ganglion.». Journal of Anatomy 184 (1): 111-7. PMC 1259932. PMID 8157483.
- ↑ Campenot, RB (1977). «Local control of neurite development by nerve growth factor». Proc Natl Acad Sci U S A 74 (10): 4516-9. Bibcode:1977PNAS...74.4516C. PMC 431975. PMID 270699. doi:10.1073/pnas.74.10.4516.
Enlaces externos[editar]
- Foto de anatomía:31:07-0201 en el Centro Médico de SUNY Downstate