Fertilización humana
Abajo: Embrión de una célula (1cE) con los dos PB=corpúsculos polares
y los dos Pronúcleos. Microscopio de interferencia.

La fertilización humana, fecundación humana o concepción, es la unión de un óvulo y un espermatozoide humanos, que generalmente ocurre en la trompa de Falopio. El resultado de esta unión es la producción de una célula: el cigoto o huevo fertilizado, que inicia el desarrollo del embrión.
El proceso de fecundación implica la fusión del material genético de un óvulo con el de un espermatozoide.
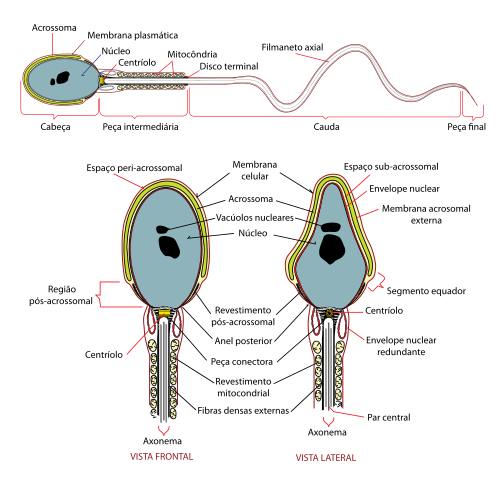
Al encontrarse con el ovocito secundario, el acrosoma del esperma produce enzimas que le permiten excavar a través de la capa gelatinosa exterior del huevo. La membrana plasmática del espermatozoide luego se fusiona con la membrana plasmática del óvulo, lo que hace que la cabeza se desconecte de su flagelo, durante el transcurso del viaje del óvulo a lo largo de la trompa hacia al útero.
La fertilización in vitro (FIV) es un proceso mediante el cual el óvulo y los espermatozoides son reunidos fuera del útero, en una probeta (in vitro).
Historia[editar]
En la creencia popular existía la suposición de que ni un hombre, ni las relaciones sexuales tenían una conexión plausible con la ocurrencia de un embarazo. Más bien, el embarazo se había atribuido a los efectos del agua, la luz del sol o la luna, o incluso la comida.[1]
Demócrito, Alcmaeon, Parménides, Empédocles y los médicos hipocráticos asumieron que en la paridad de la procreación ambos compañeros sexuales aportaban cantidades iguales de semen (semilla) y compartían esfuerzos.[2] Aristóteles concibió la formación de nuevos individuos a través de la fusión de fluidos masculinos y femeninos, con forma y función emergiendo gradualmente, en un modo que llamó epigénesis.[3] La contribución de la mujer a la concepción era la sangre menstrual (como sustancia para la nucleación) y el hombre en su semen (como intermediario representado por la forma y el movimiento en el tejido femenino).[2]
El embriólogo Karl Ernst von Baer descubrió el óvulo en 1827, recién a partir de esa investigación se creó un significado, médicamente exacto del término concepción. Anteriormente,[4] prevalecía la suposición errónea de que el esperma del hombre descubierto bajo el microscopio representaría una especie de "semilla" que contiene el embrión ya formado, que la mujer recibe como "suelo fértil" (doctrina de la preformación). Esto dio como resultado el nombre inapropiado de "semillas" para los espermatozoides, que ya no se usa en la actualidad debido a su significado engañoso. Una semilla de planta ya contiene un embrión de planta y de ninguna manera puede servir para fertilizar un óvulo de planta (ver también polinización).
Los científicos descubrieron la dinámica de la fertilización humana en el siglo XIX.[5] El fisiólogo inglés Martin Barry descubrió la penetración del esperma en el óvulo en 1842.[6]
Como resultado de los avances en la medicina reproductiva, la concepción también es posible a través de la inseminación artificial.
Anatomía[editar]
La anatomía de la fertilización humana implica en última instancia: dos gametos y un órgano llamado trompa uterina, trompa de Falopio u oviducto.

La fecundación suele ocurrir en la ampolla de la trompa, el segmento del tercio externo de la trompa del útero (oviducto).
La ampolla sola, mide de 7 a 8 centímetros de longitud y tiene 7-8 milímetros de diámetro, es la porción más larga y gruesa de la trompa de Falopio.[7]
Los espermatozoides capacitados son atraídos por la progesterona, que es secretada por las células del cúmulo que rodean al ovocito.[8] La progesterona se une al receptor CatSper en la membrana del esperma y aumenta los niveles de calcio intracelular, provocando una motilidad hiperactiva. Los espermatozoides continuarán nadando hacia concentraciones más altas de progesterona, guiándolos efectivamente hacia el ovocito.[9]
Fases de la fecundación humana[editar]
La fertilización se suele dividir clásicamente para su estudio, en al menos tres fases: fase 1 Penetración de la corona radiata, fase 2 Penetración de la zona pelúcida, fase 3 fusión de las membranas.[10]
Penetración[editar]
Para llegar hasta el ovocito, el espermatozoide debe atravesar la corona radiata y la zona pelúcida, dos capas diferentes que cubren, rodean y protegen al ovocito.
Corona radiata[editar]
El espermatozoide se desliza a través de las células de la corona radiata, la capa de la granulosa que ahora rodea el ovocito fuera del folículo y del ovario mientras transita la trompa uterina.
Capacitación del espermatozoide[editar]
El espermatozoide debe someterse a una capacitación en el tracto reproductivo de la mujer durante varias horas, lo que aumenta su motilidad y desestabiliza su membrana, preparándolo para la reacción acrosómica, que asegura la penetración enzimática de la membrana resistente del huevo, la zona pelúcida, que rodea al ovocito.[11]
Zona pelúcida[editar]


Después de unirse a la corona radiata, el esperma llega a la zona pelúcida, que es una matriz extracelular de glicoproteínas. Una molécula complementaria especial en la superficie de la cabeza del esperma se une a una glicoproteína ZP3 en la zona pelúcida. Esta unión hace que el acrosoma explote, liberando enzimas que ayudan a los espermatozoides a atravesar la zona pelúcida.
Algunos espermatozoides consumen prematuramente su acrosoma en la superficie del óvulo, lo que facilita la penetración de otros espermatozoides. Como población, los espermatozoides tienen en promedio un 50% de similitud genómica, por lo que las reacciones acrosómicas prematuras ayudan a la fertilización por parte de un miembro de la misma cohorte.[12] Puede considerarse como un mecanismo de selección de parentesco.
Estudios recientes han demostrado que el huevo no es pasivo durante este proceso.[13][14]
Espacio perivitelino[editar]
El espacio perivitelino (PVS en inglés) es un espacio virtual entre la zona pelúcida (ZP) y la membrana celular del ovocito (oolema). El EPV se asemeja a una matriz extracelular, se forma durante la ovogénesis y su tamaño varía durante el desarrollo del ovocito.
Contiene una matriz rica en ácido hialurónico y componentes que son filtrados a través de la ZP, como fluido del antro folicular y contiene proteínas producidas por las células del cúmulus.
El contenido proteico del EPV se modifica tras la exocitosis de los gránulos corticales (GC), las proteínas contenidas en estos organelos se dispersan dentro del EPV y producen un incremento significativo en su tamaño.[15]
Reacción cortical[editar]
Los espermatozoides van más profundo después de la zona pelúcida, y entonces se produce una reacción de zona o reacción cortical en la superficie del ovocito. Los gránulos corticales dentro del óvulo, se fusionan con la membrana plasmática de la célula, lo que hace que las enzimas del interior de estos gránulos sean expulsadas por exocitosis a la zona pelúcida. Esto a su vez hace que las glicoproteínas en la zona pelúcida se hagan reticulares -las enzimas hidrolizan la proteína ZP2 a ZP2f- haciendo que toda la matriz dura e impermeable a los espermatozoides. Esto evita la fertilización de un óvulo por más de un espermatozoide. La reacción cortical y la reacción acrosómica son esenciales para garantizar que solo un espermatozoide fertilice un óvulo.[16]
Cono de atracción y membrana perivitelina[editar]
Donde el espermatozoide está a punto de perforar, la yema (ooplasma) del óvulo se extrae en una elevación cónica, denominada cono de atracción o cono de recepción. Una vez que ha entrado el espermatozoide, la porción periférica de la yema se convierte en una membrana, la membrana perivitelina, que evita el paso de espermatozoides adicionales.[17]
Fusión de membranas[editar]
Luego de la adhesión, las membranas plasmáticas del espermatozoide y el óvulo se fusionan. La membrana plasmática que cubre la capucha del acrosoma desaparece durante la "reacción acrosomal", y se produce la fusión entre la membrana del oocito y la membrana que cubre la región posterior de la cabeza del espermatozoide. En el humano la cabeza y la pieza intermedia del espermatozoide entran en contacto con el citoplasma del oocito, pero la membrana plasmática que las cubre es abandonada sobre la superficie del oocito.[18]
Después de que el espermatozoide ingresa al citoplasma del ovocito, la pieza posterior y la capa externa del espermatozoide se desintegran. Se sabe que tanto las mitocondrias como la pieza posterior entran en la periferia del ovocito pero, una vez dentro, tiene lugar la degradación activa de las mitocondrias paternas y la eliminación del flagelo.[19] Se conoce que las mitocondrias del individuo adulto proceden de su madre. Existen casos en los que algunas mitocondrias del espermatozoide no son eliminadas y quedan presentes en algunos tejidos del feto, esto puede conducir a raras enfermedades genéticas. Tiene lugar la reacción cortical, lo que evita que otros espermatozoides fertilicen el mismo óvulo. El ovocito ahora sufre su segunda división meiótica produciendo el óvulo haploide y liberando un cuerpo polar. Luego, el núcleo del esperma se fusiona con el óvulo, lo que permite la fusión de su material genético.[20]
Cuando los espermatozoides ingresan al espacio vitelino, los receptores en la cabeza del esperma llamados Izumo1 se unen a Juno en la membrana del ovocito.[21] Una vez que se unen 2 bloques a la poliespermia, se producen. Después de aproximadamente 40 minutos, los otros receptores de Juno en el ovocito se pierden de la membrana, lo que hace que ya no sea fusogénico. Además, se producirá la reacción cortical que es causada por la unión de ovastacina y la escisión de los receptores ZP2 en la zona pelúcida.[22] Estos dos bloques de poliespermia son los que evitan que el cigoto tenga demasiado ADN.
Membranas celulares[editar]
Tiene lugar la fusión de las membranas celulares del ovocito secundario y el espermatozoide.
Transformaciones[editar]
En preparación para la fusión de su material genético, tanto el ovocito como el espermatozoide sufren transformaciones como reacción a la fusión de las membranas celulares.
El ovocito completa su segunda división meiótica. Esto resulta en un óvulo maduro. El núcleo del ovocito se denomina pronúcleo en este proceso, para distinguirlo de los núcleos que son el resultado de la fecundación.
La cola y las mitocondrias de los espermatozoides se degeneran con la formación del pronúcleo masculino. Es por eso que todas las mitocondrias en los seres humanos son de origen materno. Aun así, una cantidad considerable de ARN de los espermatozoides se entrega al embrión resultante y probablemente influye en el desarrollo del embrión y el fenotipo de la descendencia.[23]
Replicación[editar]
Los pronúcleos migran hacia el centro del ovocito, replicando rápidamente su ADN mientras lo hacen para preparar el cigoto para su primera división mitótica.[24]
Mitosis[editar]
Por lo general, se fusionan los 23 cromosomas del espermatozoide y los 23 cromosomas del óvulo.[25] Las membranas nucleares se disuelven sin dejar barreras entre los cromosomas del espermatozoide y el óvulo. Durante esta disolución, se forma un huso mitótico entre ellos. El huso captura los cromosomas antes de que se dispersen en el citoplasma del huevo. Después de la mitosis (que incluye la tracción de las cromátidas hacia los centríolos en anafase), la célula reúne juntos el material genético del macho y la hembra. Así, la primera mitosis de la unión de espermatozoides y ovocitos es la fusión real de sus cromosomas.[24]
Cada una de las dos células hijas resultantes de esa mitosis, tiene una copia de cada cromátida que se replicó en la etapa anterior. Por tanto, son genéticamente idénticas.
Edad de fertilización[editar]
La fertilización es el evento más comúnmente utilizado para marcar el punto cero en las descripciones del desarrollo prenatal del embrión o feto. La edad resultante se conoce como edad de fertilización, edad de fecundación, edad de concepción, edad embrionaria, edad fetal o edad de desarrollo intrauterino.[26]
La edad gestacional, por el contrario, toma el comienzo del último período menstrual (FUM) como punto cero. Por convención, la edad gestacional se calcula agregando 14 días a la edad de fertilización y viceversa.[27]
De hecho, la fecundación generalmente ocurre dentro de dos días de la ovulación, que, a su vez, ocurre en promedio 14,6 días después del comienzo de la menstruación anterior (FUM).[28] También existe una variabilidad considerable en este intervalo, con un intervalo de predicción del 95% de la ovulación de 9 a 20 días después de la menstruación, incluso para una mujer promedio que tiene un tiempo medio de FUM hasta la ovulación de 14,6.[29] En un grupo de referencia que representa a todas las mujeres, el intervalo de predicción del 95% de la FUM a la ovulación es de 8,2 a 20,5 días.
La edad de fertilización a veces también se usa después del nacimiento para estimar varios factores de riesgo. Por ejemplo, es un mejor predictor que la edad posnatal del riesgo de hemorragia intraventricular en bebés prematuros tratados con oxigenación por membrana extracorpórea.[30]
Fertilización in vitro[editar]
La fertilización in vitro es una técnica en la que, la fertilización se realiza fuera del cuerpo de la madre. Es el principal tratamiento para la esterilidad cuando otros métodos de reproducción asistida no han tenido éxito. El proceso implica el control hormonal del proceso ovulatorio, extrayendo uno o varios ovocitos de los ovarios maternos, para permitir que sean fecundados por espermatozoides en un medio líquido. El óvulo fecundado (cigoto) puede entonces ser transferido al útero.
Véase también[editar]
Referencias[editar]
- ↑ Pschyrembel: Wörterbuch Sexualität. De Gruyter. Berlin/New York 2003, Lemma Zeugungsmythen.
- ↑ a b Jutta Kollesch, Diethard Nickel: Antike Heilkunst. Ausgewählte Texte aus dem medizinischen Schrifttum der Griechen und Römer. Philipp Reclam jun., Leipzig 1979 (= Reclams Universal-Bibliothek. Band 771); 6. Auflage ebenda 1989, ISBN 3-379-00411-1, S. 24 f.
- ↑ Maienschein J. 2017. The first century of cell theory: From structural units to complex living systems. In: Stadler F. (eds.), Integrated History and Philosophy of Science. Vienna Circle Institute Yearbook. Institute Vienna Circle, University of Vienna, Vienna Circle Society, Society for the Advancement of Scientific World Conceptions, vol 20. Springer, Cham. link.
- ↑ Vgl. auch Ursula Weisser: Zeugung, Vererbung und pränatale Entwicklung in der Medizin des arabisch-islamischen Mittelalters. Erlangen 1983.
- ↑ Garrison, Fielding. An Introduction to the History of Medicine, pages 566-567 (Saunders 1921).
- ↑ Reinhard Hildebrand: Barry, Martin. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin/ New York 2005, ISBN 3-11-015714-4, S. 147.
- ↑ Solano Barboza L.A., Amezcua S. (10 de enero de 2006). «Anatomía del aparato genital femenino, UNAM» (html). Archivado desde el original el 15 de enero de 2008. Consultado el 9 de febrero de 2021.
- ↑ Oren-Benaroya, R.; Orvieto, R.; Gakamsky, A.; Pinchasov, M.; Eisenbach, M. (8 de julio de 2008). «The sperm chemoattractant secreted from human cumulus cells is progesterone». Human Reproduction 23 (10): 2339-2345. PMID 18621752. doi:10.1093/humrep/den265.
- ↑ Publicover, Steve; Barratt, Christopher (17 de marzo de 2011). «Reproductive biology: Progesterone's gateway into sperm». Nature 471 (7338): 313-314. ISSN 1476-4687. PMID 21412330. doi:10.1038/471313a.
- ↑ Sadler T.W. (2007). «3:Primera semana del desarrollo, de la ovulación a la implantación». Langman Embriología Médica, con orientación clínica (10a edición). Médica Panamericana. pp. 37-39.
- ↑ «Fertilization». Universidad de Colorado. 2000. Archivado desde el original el 24 de junio de 2010. Consultado el 28 de julio de 2010.
- ↑ Angier, Natalie (12 de junio de 2007). New York Times, ed. «Sleek, Fast and Focused: The Cells That Make Dad Dad». Archivado desde el original el 29 de abril de 2017.
- ↑ Suzanne Wymelenberg, Science and Babies, National Academy Press, page 17
- ↑ Richard E. Jones: Kristin H. Lopez, Human Reproductive Biology, Third Edition, Elsevier, 2006, page 238
- ↑ Talbot P.; Dandekar P. «Perivitelline space: Does it play a role in blocking polyspermy in mammals?». Microscopy Research and Technique 61 (4): 349-357.
- ↑ «Fertilization: The Cortical Reaction». Boundless. Boundless. Archivado desde el original el 10 de abril de 2013. Consultado el 14 de marzo de 2013.
- ↑ «Fertilization of the Ovum». Gray's Anatomy. Archivado desde el original el 2 de diciembre de 2010. Consultado el 16 de octubre de 2010.
- ↑ Mishra S. (2019). «3:First week of development Ovulation to implantation». Langman’s Medical Embryology. Wolters kluwer india Pvt. pp. 39-40.
- ↑ Cardona Maya W., Cadavid A.P. (2010). «¿Entran el axonema y las mitocondrias espermáticas en el oocito durante el proceso de la Fecundación?». Actas Urol Esp (Medellín, Colombia: SciELO) 34 (2). Consultado el 9 de febrero de 2021.
- ↑ Mendel Y., Kaisermann J., Pawlowski M. (2019). «Gametogénesis humana y fertilización, Proceso de fertilización humana». Genética médica 1. Cambridge Stanford Books.
- ↑ Bianchi, Enrica; Wright, Gavin J (1 de julio de 2014). «Izumo meets Juno». Cell Cycle 13 (13): 2019-2020. PMC 4111690. PMID 24906131. doi:10.4161/cc.29461.
- ↑ Burkart, Anna D.; Xiong, Bo; Baibakov, Boris; Jiménez-Movilla, Maria; Dean, Jurrien (2 de abril de 2012). «Ovastacin, a cortical granule protease, cleaves ZP2 in the zona pellucida to prevent polyspermy». The Journal of Cell Biology 197 (1): 37-44. PMC 3317803. PMID 22472438. doi:10.1083/jcb.201112094.
- ↑ Jodar, Meritxell; Selvaraju, Sellappan; Sendler, Edward; Diamond, Michael P.; Krawetz, Stephen A.; Reproductive Medicine, Network. (November 2013). «The presence, role and clinical use of spermatozoal RNAs». Human Reproduction Update 19 (6): 604-624. PMC 3796946. PMID 23856356. doi:10.1093/humupd/dmt031.
- ↑ a b Marieb, Elaine M. Human Anatomy and Physiology, 5th ed. pp. 1119-1122 (2001). ISBN 0-8053-4989-8
- ↑ «Archived copy». Archivado desde el original el 6 de octubre de 2016. Consultado el 31 de julio de 2016.
- ↑ Wagner, Filip; Erdösová, Bela; Kylarová, Dana (2004-12). «Degradation phase of apoptosis during the early stages of human metanephros development». Biomedical Papers of the Medical Faculty of the University Palacky, Olomouc, Czechoslovakia 148 (2): 255-256. ISSN 1213-8118. PMID 15744391.
- ↑ Robinson, H. P.; Fleming, J.E.E. (September 1975). «A critical evaluation of sonar 'crown‐rump length' measurements». BJOG: An International Journal of Obstetrics and Gynaecology 82 (9): 702-710. PMID 1182090. doi:10.1111/j.1471-0528.1975.tb00710.x.
- ↑ Geirsson, R. T. (1 de mayo de 1991). «Ultrasound instead of last menstrual period as the basis of gestational age assignment». Ultrasound in Obstetrics and Gynecology 1 (3): 212-219. PMID 12797075. doi:10.1046/j.1469-0705.1991.01030212.x.
- ↑ Derived from a standard deviation in this interval of 2.6, as given in: Fehring, Richard J.; Schneider, Mary; Raviele, Kathleen (May 2006). «Variability in the Phases of the Menstrual Cycle». Journal of Obstetric, Gynecologic & Neonatal Nursing 35 (3): 376-384. PMID 16700687. doi:10.1111/j.1552-6909.2006.00051.x.
- ↑ Jobe, Alan H. (2004). «Post-conceptional age and IVH in ECMO patients». The Journal of Pediatrics 145 (2): A2. doi:10.1016/j.jpeds.2004.07.010.
Enlaces externos[editar]
- Esta obra contiene una traducción total derivada de «Human fertilization» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.
- Esta obra contiene una traducción parcial derivada de «Empfängnis» de Wikipedia en alemán, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.