Diferencia entre revisiones de «Acetona»
Sin resumen de edición |
m Revertidos los cambios de 200.28.73.104 a la última edición de Wilfredor |
||
| Línea 23: | Línea 23: | ||
|FrasesR = {{R11}}, {{R36}}, {{R66}}, {{R67}} |
|FrasesR = {{R11}}, {{R36}}, {{R66}}, {{R67}} |
||
|FrasesS = {{S2}}, {{S9}}, {{S16}}, {{S26}} |
|FrasesS = {{S2}}, {{S9}}, {{S16}}, {{S26}} |
||
|RTECS=AL31500000 |
|RTECS=AL31500000 |
||
|relac1n=[[Cetona]] |
|relac1n=[[Cetona]]s relacionadas |
||
|relac1d=[[Butanona]] |
|relac1d=[[Butanona]] |
||
|relac2n=Otros compuestos relacionados |
|relac2n=Otros compuestos relacionados |
||
| Línea 176: | Línea 176: | ||
[[uk:Ацетон]] |
[[uk:Ацетон]] |
||
[[zh:丙酮]] |
[[zh:丙酮]] |
||
藤岡 ハルヒ---------藤岡 ハルヒ-藤岡 ハルヒ by haruhi fujioka ^^ |
|||
Revisión del 13:19 10 ago 2010
| Acetona | ||
|---|---|---|
   | ||
| Nombre IUPAC | ||
| Propanona | ||
| General | ||
| Otros nombres |
Dimetilcetona Acetona ß-cetopropano | |
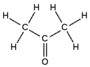
| Fórmula semidesarrollada | CH3(CO)CH3 | |
| Fórmula estructural | Imagen de la estructura | |
| Fórmula molecular | C3H6O | |
| Identificadores | ||
| Número CAS | 67-64-1[1] | |
| Número RTECS | AL31500000 | |
| ChEBI | 15347 | |
| ChEMBL | CHEMBL14253 | |
| ChemSpider | 175 | |
| PubChem | 180 | |
| UNII | 1364PS73AF | |
| KEGG | C00207 D02311, C00207 | |
| Propiedades físicas | ||
| Apariencia | Incoloro | |
| Densidad | 790 kg/m³; 79 g/cm³ | |
| Masa molar | 5804 g/mol | |
| Punto de fusión | 178,2 K (−95 °C) | |
| Punto de ebullición | 329,4 K (56 °C) | |
| Viscosidad | 0,32 cP a 20 °C (293 K) | |
| Índice de refracción (nD) | 1.35900 (20 °C) | |
| Propiedades químicas | ||
| Acidez | 19,16±0,04 pKa | |
| Solubilidad en agua | Soluble. También puede disolverse en etanol, isopropanol y tolueno | |
| Momento dipolar | 2,91 D | |
| Peligrosidad | ||
| Punto de inflamabilidad | 253 K (−20 °C) | |
| NFPA 704 |
3
1
0
| |
| Temperatura de autoignición | 738 K (465 °C) | |
| Frases R | Plantilla:R11, Plantilla:R36, Plantilla:R66, Plantilla:R67 | |
| Frases S | Plantilla:S2, Plantilla:S9, Plantilla:S16, Plantilla:S26 | |
| Riesgos | ||
| Ingestión | Náuseas, vómitos (para mayor información, véase Inhalación). | |
| Inhalación | Salivación, confusión mental, tos, vértigo, somnolencia, dolor de cabeza, dolor de garganta, pérdida del conocimiento. | |
| Piel | Piel seca, enrojecimiento. | |
| Ojos | Enrojecimiento, dolor, visión borrosa. Posible daño en la córnea. | |
| LD50 | >2000 mg/kg, oral (en ratas) | |
| Compuestos relacionados | ||
| Cetonas relacionadas | Butanona | |
| Otros compuestos relacionados |
Propano Propanal Ácido propílico | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
La acetona o propanona es un compuesto químico de fórmula química CH3(CO)CH3 del grupo de las cetonas que se encuentra naturalmente en el medio ambiente. A temperatura ambiente se presenta como un líquido incoloro de olor característico. Se evapora fácilmente, es inflamable y es soluble en agua. La acetona sintetizada se usa en la fabricación de plásticos, fibras, medicamentos y otros productos químicos, así como disolvente de otras sustancias químicas.
Nomenclatura
La nomenclatura de la acetona según la IUPAC es propanona. Y la nomenclatura común es dimetil cetona. Son erróneas por redundantes las denominaciones 2-propanona y propan-2-ona porque el grupo funcional cetona sólo puede encontrarse en el segundo carbono de la molécula.
Solubilidad
Este compuesto es miscible en agua.
Química Industrial
Procesos de fabricación
La síntesis a escala industrial[2] de la acetona se realiza mayoritariamente (90% de la capacidad en los EEUU) según el proceso catalítico de hidrólisis en medio ácido del hidroperóxido de cumeno, que permite también la obtención de fenol como coproducto, en una relación en peso de 0,61:1
Un segundo método de obtención (6% de la capacidad de los EEUU en 1995) es la deshidrogenación catalítica del alcohol isopropílico.
Otras vías de síntesis de acetona:
- Biofermentación
- Oxidación de polipropileno
- Oxidación de diisopropilbenceno
Producción
EE.UU.
En los EE.UU, el 90% de la producción de acetona manufacturada se realiza mediante el proceso de peroxidación de cumeno con una capacidad que alcanzó en el 2002 los 1,839 millones de toneladas. En el 2002 la capacidad se repartía en 11 plantas de fabricación pertenecientes a 8 compañías:[3]
Miles de toneladas:
- Sunoco (Frankford, Haverhill) 576
- Shell (Deer Park-Texas) 324
- Ineos Phenol (Theodore-Alabama) 274
- Dow (Freeport, Institute) 256
- MVPPP (Mount Vernon) 195
- Georgia Gulf (Pasadena, Plaquemine) 181
- JLM Chemicals (Blue Island) 25
- Goodyear Tire & Rubber (Bayport) 8
Total 1,839 millones de toneladas
España
Según el directorio[4] de la Federación empresarial de la industria química española (FEIQUE) 5 compañías se dedican en España a la fabricación industrial de acetona:
- Cepsa Química (La Rábida,Palos de la Frontera, HUELVA)
- Química Farmacéutica Bayer, S.A.
- Rhodia Iberia S.A.
- Cor Química S.L. (Valdemoro, Madrid)
- Quality Chemicals S.L. (Esparraguera, Barcelona)
Aplicaciones industriales y demanda

La repartición de las aplicaciones del uso de acetona en los EE.UU. se encontraba en el 2002 en los siguientes segmentos:[3]
- Cianohidrina acetona para Metil metacrilato (MMA) 42%
- Bisfenol A 24%
- Disolventes 17%
- Derivados del Aldol (MIBK y MIBC) 13%
- Varios 4%
La aplicación más importante de la acetona se encuentra en la fabricación de Metil metacrilato (MMA), mercado que experimenta una demanda creciente (3% anual) desde el 2002 por el incremento en los usos del Polimetilmetacrilato (PMMA), un material antifragmentación alternativo al vidrio en la industria de la construcción.
La demanda de Bisfenol-A y de resinas de policarbonato se ha duplicado en la década de los 1990, convirtiéndose en la segunda aplicación importante de la acetona (7% incremento anual), demandada por la industria del automóvil y de microelectrónica (fabricación de discos CD y DVD).
La demanda de acetona es un indicador del crecimiento económico de cada región ya que depende directamente de la marcha de las industrias del automóvil, construcción y microelectrónica. Así entre el 2000-2001 la demanda decreció un 9% mientras que en el 2002 apuntó una recuperación como resultado del resurgimiento económico estadounidense.
En los EE.UU. la demanda interna en el 2002 fue de 1,188 millones de toneladas, con un crecimiento medio en el periodo 1997-2002 del 0,9%. En el 2006 la demanda prevista era de 1,313 millones de toneladas.
Estado en el medioambiente
Se encuentra en forma natural en plantas, árboles y en las emisiones de gases volcánicos o de incendios forestales, y como producto de degradación de las grasas corporales. También se encuentra presente en los gases de tubos de escape de automóviles, en humo de tabaco y en vertederos. Los procesos industriales aportan una mayor cantidad de acetona al medio ambiente que los procesos naturales.
Metabolismo
La acetona se forma en la sangre cuando el organismo utiliza grasa en vez de glucosa como fuente de energía. Si se forma acetona, esto usualmente indica que las células carecen de suficiente insulina o que no pueden utilizar la presente en la sangre para convertir glucosa en energía. La acetona sigue su curso corporal hasta llegar a la orina. El aliento de personas que tienen gran cantidad de acetona en el organismo exhala olor a fruta y a veces se le denomina "aliento de acetona".
Riesgos para la salud
Si una persona se expone a la acetona, ésta pasa a la sangre y es transportada a todos los órganos en el cuerpo. Si la cantidad es pequeña, el hígado la degrada a compuestos que no son perjudiciales que se usan para producir energía para las funciones del organismo. Sin embargo, respirar niveles moderados o altos de acetona por períodos breves puede causar irritación de la nariz, la garganta, los pulmones y los ojos; dolores de cabeza; mareo; confusión; aceleración del pulso; efectos en la sangre; náusea; vómitos; pérdida del conocimiento y posiblemente coma. Además, puede causar acortamiento del ciclo menstrual en mujeres.
Tragar niveles muy altos de acetona puede producir pérdida del conocimiento y daño a la mucosa bucal. Contacto con la piel puede causar irritación y daño a la piel.
El aroma de la acetona y la irritación respiratoria o la sensación en los ojos que ocurren al estar expuesto a niveles moderados de acetona son excelentes señales de advertencia que pueden ayudarlo a evitar respirar niveles perjudiciales de acetona.
Los efectos de exposiciones prolongadas sobre la salud se conocen principalmente debido a estudios en animales. Las exposiciones prolongadas en animales produjeron daño del riñón, el hígado y el sistema nervioso, aumento en la tasa de defectos de nacimiento, y reducción de la capacidad de animales machos para reproducirse. No se sabe si estos mismos efectos pueden ocurrir en seres humanos.
Véase también
Referencias
- ↑ Número CAS
- ↑ Informe en http://www.inchem.org/documents/sids/sids/67641.pdf
- ↑ a b Informe en http://www.the-innovation-group.com/ChemProfiles/Acetone.htm
- ↑ FEIQUE, directorio de empresas de comercialización y fabricación de acetona en España. En http://www.adinte.net/basefeique/Empresasporproductos.asp?codigop=65
Enlaces externos
 Wikimedia Commons alberga una galería multimedia sobre Acetona.
Wikimedia Commons alberga una galería multimedia sobre Acetona.- ATSDR en Español - Resumen de Salud Pública: Acetona: Departamento de Salud y Servicios Humanos de EE.UU. (dominio público)
- ATSDR en Español - ToxFAQs™: Acetona: Departamento de Salud y Servicios Humanos de EE.UU. (dominio público)
- Instituto nacional de Seguridad e Higiene en el Trabajo de España: Ficha internacional de seguridad química de la acetona.

