Diferencia entre revisiones de «Catálisis»
uuuuu |
m Revertidos los cambios de 84.120.236.177 a la última edición de Taichi |
||
| Línea 4: | Línea 4: | ||
Los catalizadores que aumentan la velocidad de la reacción son denominados '''catalizadores positivos'''; mientras que los que disminuyen la velocidad de la reacción son denominados '''inhibidores''' . A su vez, las sustancias que aumentan la actividad de los catalizadores son denominados '''promotores''', y las que los desactivan son denominados '''venenos catalíticos'''. |
Los catalizadores que aumentan la velocidad de la reacción son denominados '''catalizadores positivos'''; mientras que los que disminuyen la velocidad de la reacción son denominados '''inhibidores''' . A su vez, las sustancias que aumentan la actividad de los catalizadores son denominados '''promotores''', y las que los desactivan son denominados '''venenos catalíticos'''. |
||
| ⚫ | Por ejemplo, en la reducción del [[etino]] a [[eteno]], el catalizador [[paladio]] (Pd) es "envenenado" parcialmente con [[acetato de plomo(II)]] (Pb(CH<sub>3</sub>COO)<sub>2</sub>). Sin la desactivación del catalizador, el eteno producido se reducirá posteriormente a [[etano]].<ref>W.P. Jencks, “Catalysis in Chemistry and Enzymology” McGraw-Hill, New York, 1969. ISBN 0070323054</ref><ref>Myron L Bender, Makoto Komiyama, Raymond J Bergeron “The Bioorganic Chemistry of Enzymatic Catalysis” Wiley-Interscience, Hoboken, U.S., 1984 ISBN 0471059919</ref> |
||
Por ejemplo, en la reducción d[[Media:[[Media:Ejemplo.ogg]][[Media:[[Media:Ejemplo.ogg]][[Media:<nowiki>Ejemplo.ogg</nowiki><nowiki>--~~~~Introduce aquí texto sin formato |
|||
---- |
|||
| ⚫ | |||
==Características== |
==Características== |
||
Revisión del 21:01 17 dic 2009

La catálisis es el proceso por el cual la velocidad de una reacción química es aumentada o disminuida por medio de una sustancia química conocida como el catalizador. A diferencia de otros reactivos que participan en la reacción química, un catalizador no es consumido por la reacción misma. El catalizador, por definición, no cambia su concentración, sin embargo, es posible que sí participe en la reacción global, y se habla entonces de una reacción autocatalítica. Los catalizadores pueden participar en transformaciones químicas múltiples.
Los catalizadores que aumentan la velocidad de la reacción son denominados catalizadores positivos; mientras que los que disminuyen la velocidad de la reacción son denominados inhibidores . A su vez, las sustancias que aumentan la actividad de los catalizadores son denominados promotores, y las que los desactivan son denominados venenos catalíticos.
Por ejemplo, en la reducción del etino a eteno, el catalizador paladio (Pd) es "envenenado" parcialmente con acetato de plomo(II) (Pb(CH3COO)2). Sin la desactivación del catalizador, el eteno producido se reducirá posteriormente a etano.[1][2]
Características
La característica general de la catálisis es que la reacción catalítica tiene un cambio en energía libre de la etapa limitante al estado de transición que la correspondiente reacción no catalizada, resultando en una velocidad de reacción más grande a la misma temperatura. Sin embargo, el origen mecanístico de la catálisis es complejo.
Los catalizadores pueden afectar el entorno de reacción favorablemente, por ejemplo los catalizadores ácidos para las reacciones de los compuestos carbonílicos; formar intermediarios específicos que no son producidos naturalmente, como los ésteres de osmiato en la dihidroxilación de alquenos catalizada por tetróxido de osmio; u ocasionar la lisis de los reactivos a formas activas, tales como el hidrógeno atómico en la hidrogenación catalítica.
Cinéticamente, las reacciones catalíticas se comportan como las reacciones químicas típicas, esto es, la velocidad de reacción depende de la frecuencia de contacto de los reactantes en la etapa determinante de la velocidad (ver ecuación de Arrhenius). Usualmente, el catalizador participa en esta etapa lenta, y las velocidades son limitadas por la cantidad de catalizador. En la catálisis heterogénea, la difusión de los reactivos a la superficie de contacto, y la difusión de los productos desde dicha superficie puede ser la etapa determinante. Se aplican eventos análogos asociados a la fijación con el sustrato, y a la disociación del producto en la catálisis homogénea.
Aunque los catalizadores no son consumidos por la misma reacción, pueden resultar inhibidos, desactivados, o destruidos por procesos secundarios.
Principios generales de la catálisis
Mecanismo típico
Los catalizadores generalmente reaccionan con uno o más reactantes para formar intermediarios que, subsecuentemente, conducen al producto final de la reacción. En el proceso, se regenera el catalizador. El siguiente esquema es típico de una reacción catalítica, donde C representa el catalizador, X y Y son reactantes, y Z es el producto de la reacción de X y Y:
- X + C → XC (1)
- Y + XC → XYC (2)
- XYC → CZ (3)
- CZ → C + Z (4)
Aunque el catalizador es consumido por la reacción 1, es producido subsecuentemente por la reacción 4, por lo que la reacción global es:
- X + Y → Z
A la par con la regeneración del catalizador en una reacción, frecuentemente sólo pequeñas cantidades se necesitan para incrementar la velocidad de la reacción. Sin embargo, en la práctica los catalizadores son algunas veces consumidos en procesos secundarios.
Como ejemplo de este proceso, en el 2008, investigadores daneses revelaron por primera vez la secuencia de eventos cuando el oxígeno y el hidrógeno se combinan sobre una superficie de dióxido de titanio (TiO2, o titania) para producir agua. Con una serie de imágenes de microscopía de barrido de túnel a intervalos, determinaron que las moléculas sufren adsorción, disociación y difusión antes de reaccionar. Los estados intermediarios de reacción fueron: HO2, H2O2, luego H3O2 y el producto final de la reacción (el dímero de la molécula de agua), tras lo cual la molécula de agua se desorbe de la superficie del catalizador.[3]
Catálisis y energética de la reacción
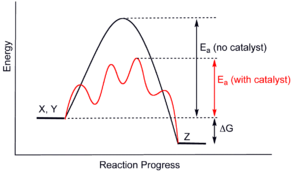
Los catalizadores funcionan proveyendo un mecanismo (alternativo) que involucra un estado de transición diferente y una energía de activación menor. Consecuentemente, más colisiones moleculares tienen la energía necesaria para alcanzar el estado de transición. En consecuencia, los catalizadores habilitan reacciones que de otro modo estarían bloqueadas o ralentizadas por una barrera cinética. El catalizador puede aumentar la velocidad de reacción o selectividad, o permitir que la reacción se dé a menores temperaturas. Este efecto puede ser ilustrado con una distribución de Boltzmann y un diagrama de perfil de energía.
Los catalizadores no cambian el rendimiento de una reacción: no tienen efecto en el equilibrio químico de una reacción, debido a que la velocidad, tanto de la reacción directa como de la inversa, son afectadas (ver también termodinámica). El hecho de que un catalizador no cambie el equilibrio es una consecuencia de la segunda ley de la termodinámica. Supóngase que hay un catalizador que modifique el equilibrio. La adición de catalizador al sistema resultaría en una reacción que desplazaría el nuevo equilibrio, produciendo energía. La producción de energía es un resultado necesario, puesto que las reacciones son espontáneas sí y sólo sí se produce energía libre de Gibbs, y si no hay una barrera energética, no hay necesidad de un catalizador. En consecuencia, la eliminación del catalizador resultaría en reacción, produciendo energía; esto es, la adición, y su proceso inverso, la eliminación, producirían energía. En consecuencia, un caalizador que pueda cambiar el equilibrio sería un máquina de movimiento perpetuo, una contradicción a las leyes de la termodinámica.[4]
Si un catalizador sí cambia el equilibrio, entoncs debe ser consumido en el curso de la reacción, y en consecuencia también es un reactante. Algunos ejemplos ilustrativos son la hidrólisis de los ésteres catalizada por bases, donde el ácido carboxílico producido reacciona inmediatamente con el catalizador base, con lo que el equilibrio de la reacción se desvía hacia la hidrólisis.
La unidad derivada SI para medir la actividad catalítica de un catalizador es el katal, que es moles por segundo. La actividad de un catalizador puede ser descrita por el número de conversiones, o TON (del ingles turn over number), y la eficiencia catalítica por la frecuencia de conversiones, TOF (del inglés turn over frequency). El equivalente bioquímico es la unidad enzima. Para más información sobre la eficiencia de la catálisis enzimática, ver el artículo de Enzimas.
El catalizador estabiliza el estado de transición más que estabilizar el material inicial. Disminuye la barrera cinética al disminuir la diferencia en energía entre el material inicial y el estado de transición.
Materiales catalíticos típicos
La naturaleza química de los catalizadores es tan diversa como la catálisis misma, aunque pueden hacerse algunas generalizaciones. Los ácidos próticos son probablemente los catalizadores más ampliamente usados, especialmente para muchas reacciones que involucran agua, incluyendo hidrólisis y su inversa. Los sólidos multifuncionales suelen ser catalíticamente activos, por ejemplo las zeolitas, alúmina y ciertas formas de carbono grafítico. Los metales de transición son usados frecuentemente para catalizar reacciones redox (oxigenación, hidrogenación). Muchos procesos catalíticos, especialmente los que involucran hidrógeno, requieren metales del grupo del platino.
Algunos así llamados catalizadores son, en realidad, precatalizadores. Los precatalizadores se convierten en el catalizador en el transcurso de la reacción. Por ejemplo, el catalizador de Wilkinson RhCl(PPh3)3 pierde un ligando trifenilfosfina antes de entrar en el verdadero ciclo catalítico. Los precatalizadores son más fáciles de almacenar, pero son fácilmente activados in situ. Debido a esta etapa de preactivación, muchas reacciones catalíticas involucran un período de inducción.
Las especies químicas que mejoran la actividad catalítica son denominadas co-catalizadores o promotores, en catálisis cooperativa.
Naturaleza del proceso
La velocidad de reacción depende de las velocidades de los pasos del mecanismo. La función del catalizador es simplemente proveer un mecanismo adicional (ruta diferente) para ir de reactivos a productos. Este mecanismo de alternativa tiene una energía de activación menor que el mecanismo en ausencia de catalizador; por otra parte, normalmente el Factor de frecuencia A —véase también cinética y mecanismos de reacción— es parecido para la reacción no catalizada y la catalizada. De aquí que la constante de velocidad de la reacción catalizada sea mayor que la no catalizada.
Tipos de catalizadores
Los catalizadores pueden ser sustancias de distintos tipos: elementos (paladio, níquel, etc.), compuestos inorgánicos ([[Dióxido de manganeso|MnO2), o compuestos orgánicos. Los catalizadores orgánicos pueden ser sintetizados en el laboratorio, o tener un origen natural y biológico.
En este útlimo caso, los de origen biológico, son llamados biocatalizadores, son biomoléculas responsables de regular la velocidad de un gran número de reacciones en los seres vivos, incluyendo todo el metabolismo. Los biocatalizadores más importantes son las enzimas, de naturaleza proteica; aunque también existen ácidos ribonucleicos con capacidad catalítica, denominados ribozimas. Véase, por ejemplo, la ADN polimerasa.
Los catalizadores sólidos pueden ser porosos y están hechos de metal u óxido metálico soportado sobre una matriz sólida inerte. Este caso particular se conoce como catálisis de contacto. Este tipo de catalizadores son ampliamente utilizados en las refinerías de petróleo.
Clasificación de la catálisis
La catálisis se clasifica en función de la naturaleza química del medio de la reacción. A partir del número de fases presentes y de la química implicada es posible agrupar de acuerdo a su aplicación.
- Catálisis homogénea: Cuando los catalizadores están en la misma fase que los reactivos. Actúan cambiando el mecanismo de reacción. Es decir, se combinan con alguno de los reactivos para formar un intermedio inestable. Éste a su vez se combina con más reactivo dando lugar a la formación de los productos, al mismo tiempo que se regenera el catalizador.
- Catálisis ácido-base
- Catálisis heterogénea o de contacto: Cuando los catalizadores están en distinta fase que los reactivos. Son materiales capaces de adsorber moléculas de reactivo en sus superficies, consiguiendo mayor concentración y superficie de contacto entre reactivos, o debilitando sus enlaces disminuyendo la energía de activación. Los productos abandonan el catalizador cuando se forman, y este queda libre para seguir actuando. Los catalizadores heterogéneos más usados son metales u óxidos de metales finamente divididos, como por ejemplo el hierro, el platino, el níquel, el trióxido de aluminio o el pentaóxido de vanadio.
- Catálisis enzimática
Aplicaciones
En los procesos industriales, la catálisis es de enorme importancia, ya que permite llevar a cabo las reacciones en tiempos mucho más cortos, con el consiguiente beneficio económico. Véase, por ejemplo, el proceso de Haber.
Aunque los catalizadores no se consumen directamente en la reacción, sí que hay que tener en cuenta la posibilidad del envenenamiento de un catalizador: la reacción con una impureza que convierte el catalizador en otra sustancia (otro compuesto químico) sin actividad catalítica.
Diagramas de energía

La figura muestra el diagrama de una reacción catalizada, mostrando como varía la energía (E) de las moléculas que participan en la reacción durante el proceso de reacción (tiempo, t). Todas las moléculas contienen una cantidad determinada de energía, que depende del número y del tipo de enlaces presentes en ella. Los sustratos o reactivos,(A y B) tienen una energía determinada, y el o los productos (AB en el gráfico) otra.
Si la energía total de los sustratos es mayor que la de los productos (por ejemplo como se muestra en el diagrama), una reacción exotérmica, y el exceso de energía se desprende en forma de calor. Por el contrario, si la energía total de los sustratos es menor que la de los productos, se necesita tomar energía del exterior para que la reacción tenga lugar, lo que se denomina reacción endotérmica.
Cuando las moléculas de los sustratos se van acercando para reaccionar, pierden estabilidad (usando una analogía antropomórfica, a las moléculas "les gusta" mantener su espacio vital, y las intromisiones no son bienvenidas). La inestabilidad se manifiesta como un aumento de la energía del sistema (es el pico de energía que se ve en el diagrama). Cuando los sustratos se convierten en productos, las moléculas se separan y se relajan de nuevo, y el conjunto se estabiliza.
Las enzimas catalizan las reacciones estabilizando el intermedio de la reacción, de manera que el "pico" de energía necesario para pasar de los sustratos a los productos es menor. El resultado final es que hay muchas más moléculas de sustrato que chocan y reaccionan para dar lugar a los productos, y la reacción transcurre en general más deprisa. Un catalizador puede catalizar tanto reacciones endotérmicas como exotérmicas, porque en los dos casos es necesario superar una barrera energética. El catalizador (E) crea un microambiente en el que A y B pueden alcanzar el estado intermedio (A...E...B) más fácilmente, reduciendo la cantidad de energía necesaria (E2). Como resultado, la reacción es más fácil, optimizando la velocidad de dicha reacción.
Los catalizadores no alteran el equilibrio químico propio de la reacción en ningún caso.
Referencias
- ↑ W.P. Jencks, “Catalysis in Chemistry and Enzymology” McGraw-Hill, New York, 1969. ISBN 0070323054
- ↑ Myron L Bender, Makoto Komiyama, Raymond J Bergeron “The Bioorganic Chemistry of Enzymatic Catalysis” Wiley-Interscience, Hoboken, U.S., 1984 ISBN 0471059919
- ↑ Chemical & Engineering News, 16 February 2009, "Making Water Step by Step", p. 10
- ↑ Robertson, A.J.B. Catalysis of Gas Reactions by Metals. Logos Press, London, 1970.
