Dietilzinc
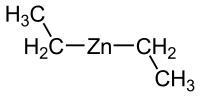 | ||
 | ||
| Nombre IUPAC | ||
| Dietilcinc | ||
| General | ||
| Fórmula molecular | (C2H5)2Zn | |
| Identificadores | ||
| Número CAS | 557-20-0[1] | |
| ChEBI | 51496 | |
| ChemSpider | 10413128 | |
| UNII | S0W5NQH7C6 | |
| Propiedades físicas | ||
| Densidad | 1205 kg/m³; 1205 g/cm³ | |
| Masa molar | 123,50 g/mol g/mol | |
| Punto de fusión | 245 K (−28 °C) | |
| Punto de ebullición | 390 K (117 °C) | |
| Propiedades químicas | ||
| Solubilidad en agua | Reacciona violentamente | |
| Peligrosidad | ||
| NFPA 704 |
3
3
3
W
| |
| Riesgos | ||
| Riesgos principales | Inflamable (F); Corrosivo (C); Peligroso para el medio ambiente (N) | |
| Piel | El contacto de este producto con la piel causa quemaduras químicas graves. | |
| Ojos | Pueden ocurrir quemaduras químicas y térmicas graves y causar daño permanente a los ojos | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El dietilcinc, de fórmula (C2H5)2Zn o DEZn, es un compuesto de organocinc formado por un átomo de cinc unido a dos grupos etilo. Este líquido incoloro es un reactivo importante en química orgánica y disponible comercialmente en solución de hexano, heptano o tolueno.
Síntesis
Edward Frankland informó en 1848 por primera vez sobre este compuesto, sintetizado a partir de cinc y yoduro de etilo, siendo el primer compuesto de organocinc descubierto.[2] Mejoró la síntesis mediante el uso de dietilmercurio como material de partida[3] La síntesis contemporánea consiste en la reacción de una mezcla 1:1 de yoduro de etilo y bromuro de etilo con un "par cinc - cobre", una fuente reactiva de cinc.[4]
Reacciones
El dietilcinc se utiliza en síntesis orgánica como fuente del sintón etilo en reacciones de adición a grupos carbonilo. Es menos nucleófilo que el etillitio y está relacionado con los reactivos de Grignard. Por ejemplo, en la adición asimétrica de benzaldehído[5] e iminas.[6]
Con diyodometano se forma un reactivo de Simmons-Smith[7][8]
Otros usos
Debido a su alta reactividad frente al aire, se utiliza en pequeñas cantidades como hipergólico o combustible líquido que sufre "autoignición", es decir, se inflama en contacto con el oxidante, por lo que el motor del cohete necesita contener solamente un sistema de bombeo, sin fuente de ignición por chispa.
El dietilcinc también fue investigado por un tiempo por la Biblioteca del Congreso de los Estados Unidos como un posible medio de desacidificación en masa de los libros impresos en papel de pulpa de madera. Los primeros experimentos consistían en colocar los libros dentro de una cámara de vacío y exponiéndolos a vapor de dietilcinc. En teoría, el vapor iba a reaccionar con los residuos de ácido en el papel, provocando su neutralización y dejando sólo un ligero residuo alcalino de óxido de cinc en el papel. Los resultados fueron inicialmente prometedores, demostrando que el pH del papel se podía incrementar hasta 7,5. Los experimentos a gran escala no dieron el mismo resultado; los prototipos construidos para la Biblioteca del Congreso por Northrop Services dejaron marcas en las páginas, produjeron que las tapas y cubiertas seagrietaran y deformaran, y dejaba malos olores. También hubo alguna evidencia de que las páginas se debilitaban físicamente, a la vez que se reducía su acidez. Además, se hizo evidente que cualquier proceso de desacidificación a gran escala con dietilcinc requeriría el transporte por camión de enormes volúmenes de productos químicos, que no se podrían hacer con seguridad debido a su volatilidad.
Aun peor, el prototipo final sufrió daños en una serie de explosiones al entrar en contacto trazas de vapor de dietilcinc y agua en la cámara. El proyecto fue finalmente abandonado.[9]
En microelectrónica, el dietilcinc se utiliza como agente dopante.
Seguridad
El dietilcinc reacciona violentamente con el agua y se enciende fácilmente al entrar en contacto con el aire. Por lo tanto, debe ser manejado con tecnología de atmósfera inerte.
Referencias
- ↑ Número CAS
- ↑ E. Frankland (1850). «On the isolation of the organic radicals». Quarterly Journal of the Chemical Society 2 (3): 263. doi:10.1039/QJ8500200263.
- ↑ E. Frankland, B. F. Duppa (1864). «On a new reaction for the production of the zinc-compounds of the alkyl-radical». Journal of the Chemical Society 17: 29-36. doi:10.1039/JS8641700029.
- ↑ C. R. Noller (1943). "Diethyl zinc". Org. Synth.; Coll. Vol. 2: 184.
- ↑ Masato Kitamura, Hiromasa Oka, Seiji Suga, and Ryōji Noyori (2004). "Catalytic Enantioselective Addition of Dialkylzincs to Aldehydes Using (2S)-(−)-3-exo-(Dimethylamino)isoborneol [(2S)-DAIB]: (S)-1-Phenyl-1-propanol". Org. Synth.; Coll. Vol. 10: 635.
- ↑ Jean-Nicolas Desrosiers, Alexandre Côté, Alessandro A. Boezio, and André B. Charette (2005). "Preparation of Enantiomerically Enriched (1S)-1-Phenylpropan-1-amine Hydrochloride by a Catalytic Addition of Diorganozinc Reagents to Imines". Org. Synth. 83: 5.
- ↑ André B. Charette and Hélène Lebel (2004). "(2S,3S)-(+)-(3-Phenylcyclopropyl)methanol". Org. Synth.; Coll. Vol. 10: 613.
- ↑ Yoshihiko Ito, Shotaro Fujii, Masashi Nakatuska, Fumio Kawamoto, and Takeo Saegusa (1988). "One-Carbon Ring Expansion of Cycloalkanones to Conjugated Cycloalkenones: 2-Cyclohepten-1-one". Org. Synth.; Coll. Vol. 6: 327.
- ↑ Nicholson Baker (2002). Double Fold: Libraries and the Assault on Paper. Vintage. ISBN 0375726217.
Enlaces externos
- Demostración de la ignición del Dietilcinc en el aire Vídeo - Universidad de Nottingham
- Dietilcinc Ficha de seguridad MSDS. Epichem.
- Dietilcinc Ficha de seguridad MSDS. AkzoNobel.

