Ácido tartárico
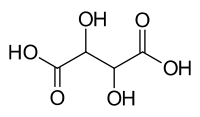
El ácido tartárico o ácido tártrico es un compuesto orgánico polifuncional, cuyo grupo funcional principal es el carboxilo (ácido carboxílico). Su fórmula es: HOOC-CHOH-CHOH-COOH, con fórmula molecular C4H6O6. Nombrado por la IUPAC como ácido 2,3-dihidroxibutanodioico. Su peso molecular es 150 g/mol.
Contiene, por tanto, dos grupos carboxílicos y dos grupos alcohol en una cadena de hidrocarburo lineal de longitud cuatro.
Origen y síntesis[editar]

El ácido tartárico tiene una gran importancia histórica ya que fue la primera molécula quiral cuyo racemato se separó en los dos enantiómeros correspondientes. A nivel de curiosidad, al racemato del ácido tartárico se le llama también ácido racémico. Esta denominación no es común, dado que las sales del ácido racémico se llamarían racematos, dando lugar a confusiones, pues un racemato de alquilo sería un racemato, pero se sabe que no todos los racematos son racematos de alquilo. Por ejemplo, el ácido manguélico es un racemato y deriva del ácido racémicoide.
Este ácido tartárico, presente en muchas plantas y la tierra, era ya conocido por los griegos y los romanos. Se encuentra en la uva en forma libre y combinada (bitartrato de potasio), siendo uno de los componentes característicos y distintivos de esta fruta. Fue aislado por primera vez el año 1769 por el químico sueco Carl Wilhelm Scheele. Posee un pKa de 3.036, se considera un ácido débil.
Luis Pasteur, en su primera contribución importante a la ciencia descubrió el dimorfismo del ácido tartárico, al observar al microscopio que el ácido racémico presentaba dos tipos de cristal, con simetría especular, contradiciendo los descubrimientos del entonces químico de primera categoría Mitscherlich. Este descubrimiento lo realizó cuando contaba con poco más de 20 años de edad. De esta forma se descubrió las formas dextrógiras y levógiras que desviaban el plano de polarización de la luz con el mismo ángulo pero en sentido contrario.[1]
Aplicaciones[editar]
El ácido tartárico es un acidificante y conservante natural (E-334). En la industria enológica puede usarse como corrector de la acidez del vino. Se utiliza a escala industrial, en la preparación de bebidas efervescentes como gaseosas.
También se utiliza en fotografía y barnices y una variante conocida como sal de Rochelle (tartrato de sodio y potasio) constituye un suave laxante.
En algunas de sus formas, (bitartrato de potasio) se usa como condimento para la comida, donde se conoce como cremor tártaro. Se utiliza en diversas recetas, especialmente en repostería y confitería para aumentar el volumen de masas y preparaciones haciéndolo reaccionar con bicarbonato para obtener un sucedáneo de fermentación; se usa también para estabilizar claras de huevo además de poder realizar merengue y pasteles como pastel del Diablo.
Así mismo, el ácido tartárico se puede utilizar en gravimetría como agente precipitante de diversos elementos como el potasio, el sodio, el magnesio, el estroncio o el tántalo.
El ácido tartárico tiene uso como agente resolvente de racematos, así como en la purificación a nivel enantiomérico de compuestos con centro estereogénicos. En estos casos, estos racematos o compuestos susceptibles de ser enriquecidos a nivel de pureza enantiomérica con el ácido tartárico, deben tener puntos básicos (el más típico es una amina), para que el ácido tartárico correspondiente pueda formar una sal de tartrato de amonio, que sea cristalizable y aislable por filtración, y así enriquecer o resolver el pertinente compuesto quiral.
Véase también[editar]
Bibliografía[editar]
- Beyer, Hans; Walter, Wolfgang (1987). Manual de química orgánica. Reverte. ISBN 9788429170665. Consultado el 20 de septiembre de 2012.
- De Rosa, Tullio (1998). Tecnología de Los Vinos Blancos. Mundi-Prensa Libros. ISBN 9788471147004.
Referencias[editar]
- ↑ Ensayo "La molécula tridimensional", séptimo capítulo del libro "El electrón es zurdo y otros ensayos" de Isaac Asimov, aproximadamente en el sitio 35,4 % del libro (aproximadamente en el sitio 30,8 % del ensayo)
Enlaces externos[editar]
 Wikimedia Commons alberga una galería multimedia sobre Ácido tartárico.
Wikimedia Commons alberga una galería multimedia sobre Ácido tartárico.
