Diferencia entre revisiones de «Glándula suprarrenal»
mSin resumen de edición |
m Se añadió la sección "Historia", creada a partir de la traducción de la sección correspondiente en el artículo en inglés. |
||
| Línea 188: | Línea 188: | ||
===== Fisiopatología ===== |
===== Fisiopatología ===== |
||
El hiperaldosteronismo produce una retención renal de sodio y perdida de potasio. esto causa una expansión del volumen extracelular y plasmático con formación de edemas;cabe destacar que la TA es normal o baja. |
El hiperaldosteronismo produce una retención renal de sodio y perdida de potasio. esto causa una expansión del volumen extracelular y plasmático con formación de edemas;cabe destacar que la TA es normal o baja. |
||
==Historia== |
|||
Se dice que [[Bartolomeo Eustachi]], anatomista italiano, hizo la primera descripción de las glándulas suprarrenales, en [[1563]]-[[1564]].<ref>{{cita libro|apellido1=Schmidt|nombre1=JE|título=Medical Discoveries: Who and When|fecha=1959|editor=Thomas|url=http://catalog.hathitrust.org/Record/001557037|páginas=9–10}}</ref><ref>{{cita libro|apellido1=O'Hare|nombre1=A. Munro Neville, Michael J.|título=The Human Adrenal Cortex Pathology and Biology -- An Integrated Approach|fecha=2012|editor=Springer London|ciudad=Londres|isbn=1447113179|páginas=Chapter 2: Historical Aspects}}</ref> Sin embargo, estas publicaciones estaban incluidas en la [[Biblioteca Apostólica Vaticana]], y la opinión pública no les prestó la atención que, en cambio, sí recibieron las ilustraciones de [[Caspar Bartolino el Viejo]], de [[1611]].<ref>{{cita libro|apellido1=O'Hare|nombre1=A. Munro Neville, Michael J.|título=The Human Adrenal Cortex Pathology and Biology -- An Integrated Approach|fecha=2012|editor=Springer London|ciudad=Londres|isbn=1447113179|páginas=Capítulo 2: Historical Aspects (Aspectos históricos)}}</ref> |
|||
Las glándulas suprarrenales se llaman así debido a que se encuentran encima de los [[riñón|riñones]]. El término ''adrenal'' proviene del [[idioma latín|latín]] ''ad-'', "cerca", y ''[[:wikt:renes|renes]]'', "riñón".<ref>{{cita web|url=http://psychology.about.com/od/aindex/g/adrenal-glands.htm|título=What Are The Adrenal Glands?|fechaacceso=18 septiembre 2013|editor=About.com}}</ref> El término ''suprarrenal'', denominado así por [[Jean Riolan el Joven]] en [[1629]], proviene del latín ''[[:wikt:supra-|supra]]'', "encima", y ''renes'', "riñón". El hecho de que se trataba de glándulas localizadas encima de los riñones se aceptó en el [[siglo XIX]], cuando los [[anatomista]]s confirmaron que no existen ductos y que muy probablemente su función era secretoria; antes de que se confirmaran esos datos, había un debate respecto a si las glándulas eran realmente suprarrenales o si formaban parte de los riñones.<ref>{{cita libro|apellido1=O'Hare|nombre1=A. Munro Neville, Michael J.|título=The Human Adrenal Cortex Pathology and Biology -- An Integrated Approach|fecha=2012|editor=Springer London|ciudad=Londres|isbn=1447113179|páginas=Capítulo 2: Historical Aspects (Aspectos históricos)}}</ref> |
|||
Una de las obras más reconocidas acerca de las glándulas suprarrenales fue ''On the Constitutional and Local Effects of Disease of the Suprarenal Capsule'' [Sobre los efectos constitucionales y locales de la enfermedad de la cápsula suprarrenal], publicaa en [[1855]] poor el médico inglés [[Thomas Addison]]. En esta monografía, el autor describe lo que más adelante el médico francés [[Georges Phillipe Trousseau]] denominaría [[enfermedad de Addison]], [[epónimo]] que sigue utilizándose para la [[insuficiencia adrenal]] y las manifestaciones clínicas relacionadas.<ref>{{cita revista|apellido1=Pearce|nombre1=JM|título=Thomas Addison (1793-1860)|revista=Journal of the Royal Society of Medicine|fecha=2004|volumen=97|número=6|páginas=297–300|doi=10.1258/jrsm.97.6.297|pmid=15173338|url=http://jrs.sagepub.com/content/97/6/297.long|pmc=1079500}}</ref> En [[1894]], los fisiólogos británicos [[George Oliver]] y [[Edward Albert Sharpey-Schafer]] estudiaron la acción de los extractor adrenales y observaron sus efectos [[antihipotensivos]] o [[vasopresores]]. En las décadas siguientes, varios médicos experimentaron con extractos de la [[glándula suprarrenal#Corteza suprarrenal|corteza suprarrenal]] para tratar la enfermedad de Addison.<ref>{{cita libro|apellido1=Schmidt|nombre1=JE|título=Medical Discoveries: Who and When|fecha=1959|editor=Thomas|url=http://catalog.hathitrust.org/Record/001557037|páginas=9–10}}</ref><ref>{{cita libro|apellido1=O'Hare|nombre1=A. Munro Neville, Michael J.|título=The Human Adrenal Cortex Pathology and Biology -- An Integrated Approach|fecha=2012|editor=Springer London|ciudad=Londres|isbn=1447113179|páginas=Chapter 2: Historical Aspects}}</ref> [[Edward Calvin Kendall]], [[Philip Showalter Hench]] y [[Tadeusz Reichstein]] recibieron en [[1950]] el [[Anexo:Ganadores del Premio Nobel de Fisiología o Medicina]], por sus descubrimientos acerca de la estructura y los efectos de las [[hormonas adrenocorticales]].<ref>{{cita web|url=http://nobelprize.org/nobel_prizes/medicine/laureates/1950/index.html|título=The Nobel Prize in Physiology or Medicine 1950|fechaacceso=10 febrero 2015|editor=Nobel Foundation}}</ref> |
|||
== Véase también == |
== Véase también == |
||
Revisión del 08:17 14 ene 2016
| Glándulas suprarrenales | ||
|---|---|---|
 Glándulas suprarrenales. | ||
| Nombre y clasificación | ||
| Sinónimos |
cápsula suprarrenal | |
| Latín | [TA]: glandula suprarenalis | |
| TA | A11.5.00.001 | |
| Información anatómica | ||
| Sistema | endocrino | |
|
| ||
Las glándulas suprarrenales son dos estructuras retroperitoneales, la derecha de forma piramidal[1] y la izquierda de forma semilunar, ambas están situadas encima de los riñones. Su función es la de regular las respuestas al estrés, a través de la síntesis de corticosteroides (principalmente cortisol) y catecolaminas (sobre todo adrenalina).
Se debe tener en cuenta que la glándula suprarrenal izquierda no es del todo superior, sino más medial. Es por ello por lo que se aconseja que se les denomine glándulas adrenales.
Se encuentran irrigadas por ramas de la arteria frénica inferior, arteria suprarrenal media (rama de la aorta abdominal), por la arteria polar superior (rama de la arteria renal) y por el arco exorrenal del riñón.
Anatomía
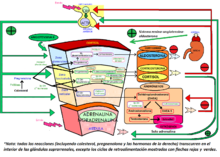
Anatómicamente hablando, las glándulas suprarrenales se sitúan en el retroperitoneo, en la cara anterosuperior de los riñones y están irrigadas por las arterias suprarrenales superior, media e inferior. Están formadas por dos estructuras diferentes que son la médula suprarrenal y la corteza suprarrenal, ambas inervadas por el sistema nervioso autónomo. Como su nombre sugiere, la médula suprarrenal está situada dentro de la glándula, rodeada por la corteza suprarrenal que forma la superficie.
Médula suprarrenal
La médula suprarrenal está compuesta principalmente por células cromafines productoras de hormonas, siendo el principal órgano de conversión de tirosina en catecolaminas como la adrenalina (epinefrina) y noradrenalina (norepinefrina). Las células de la médula suprarrenal derivan embriológicamente de la cresta neural, como neuronas modificadas. Realmente estas células son células postganglionares del sistema nervioso simpático, que reciben la inervación de células preganglionares. Como las sinapsis entre fibras pre y postganglionares ocurren en los ganglios nerviosos autonómicos, la médula suprarrenal puede considerarse como un ganglio nervioso del sistema nervioso simpático.
En respuesta a una situación estresante, como es el ejercicio físico o un peligro inminente, las células de la médula suprarrenal producen catecolaminas que son incorporadas a la sangre, en una relación 70 a 30 de epinefrina y norepinefrina, respectivamente. La epinefrina produce efectos importantes como el aumento de la frecuencia cardíaca, vasoconstriccion, broncodilatación y aumento del metabolismo, que son respuestas muy fugaces.
Corteza suprarrenal
La corteza suprarrenal o corteza adrenal está situada rodeando la circunferencia de la glándula suprarrenal. Su función es la de regular varios componentes del metabolismo con la producción de mineralocorticoides y glucocorticoides que incluyen a la aldosterona y cortisol. La corteza suprarrenal también es un lugar secundario de producción de hormonas sexuales tanto femeninas como masculinas.
La corteza suprarrenal secreta hormonas esteroideas (de naturaleza lipídica), por lo que sus células presentan abundante REL (reticulo endoplasmático liso) y mitocondrias. Basándose en los tipos celulares y la función que realizan, se divide en tres capas diferentes de tejido:
- Zona glomerular: Producción de mineralocorticoides, sobre todo, aldosterona.
- Zona fascicular: Producción de glucocorticoides, principalmente cortisol, cerca del 95%.
- Zona reticular: Producción de andrógenos, incluyendo testosterona.
Zona glomerular
Las células de la zona glomerular de la corteza suprarrenal, secretan mineralocorticoides, como la aldosterona y la desoxicorticosterona en respuesta a un aumento de los niveles de potasio o descenso del flujo de sangre en los riñones. La aldosterona es liberada a la sangre formando parte del sistema renina-angiotensina, que regula la concentración de electrolitos en la sangre, sobre todo de sodio y potasio, actuando en el túbulo contorneado distal de la nefrona de los riñones:
- Aumentando la excreción de potasio.
- Aumentando la reabsorción de sodio.
La aldosterona en resumen ayuda a regular la presión osmótica del organismo.

Zona fascicular
Capa predominante en la corteza suprarrenal, cuyas células se disponen en hileras separadas por tabiques y capilares.Sus células se llaman espongiocitos porque son voluminosas y contienen numerosos gránulos claros dando a su superficie un aspecto de esponja. Estas células segregan glucocorticoides como el cortisol, o hidrocortisona, y la cortisona al ser estimuladas por la hormona adrenocorticotropica (ACTH). La ACTH es producida por la hipófisis en respuesta al factor hipotalámico estimulante de corticotropina (CRH). Estos tres órganos del sistema endocrino forman el eje hipotálamo-hipofisario-suprarrenal.
El principal glucocorticoide producido por las glándulas suprarrenales es el cortisol, que cumple diferentes funciones en el metabolismo en múltiples células del organismo como:
- Aumenta la disponibilidad de energía y las concentraciones de glucosa en la sangre, mediante varios mecanismos:
- Estimula la proteólisis, es decir romper proteínas para la producción de aminoácidos.
- Estimula la lipólisis, es decir romper triglicéridos (grasa) para formar ácidos grasos libres y glicerol.
- Estimula la gluconeogénesis, o la producción de glucosa a partir de nuevas fuentes como los aminoácidos y el glicerol.
- Actúa como antagonista de la insulina e inhiben su liberación, lo que produce una disminución de la captación de glucosa por los tejidos.
- Tiene propiedades antiinflamatorias que están relacionadas con sus efectos sobre la microcirculación y la inhibición de las citocinas pro-inflamatorias (IL-1 e IL-6), prostaglandinas y linfocinas. Por lo tanto, regulan las respuestas inmunitarias a través del llamado eje inmunosuprarrenal.
- También el cortisol tiene efectos importantes sobre la regulación del agua corporal, retrasando la entrada de este líquido del espacio extracelular al intracelular. Por lo que favorece la eliminación renal de agua.
- El cortisol inhibe la secreción de la propiomelanocortina (precursor de ACTH), de la CRH y de la vasopresina.
Zona reticular
Es la más interna y presenta células dispuestas en cordones entrecruzados o anastomosados que segregan esteroides sexuales como estrógenos y andrógenos.
Las células de la zona reticular producen una fuente secundaria de andrógenos como testosterona, dihidrotestosterona (DHT), androstenediona y dehidroepiandrosterona (DHEA). Estas hormonas aumentan la masa muscular, estimulan el crecimiento celular, y ayudan al desarrollo de los caracteres sexuales; secundarios.
Exploración anatomofuncional de la corteza suprarrenal
Función glucocorticoide
- Determinación aislada de cortisol o ACTH: no útil debido a que la secreción es episódica (influyen cambios circadianos y el estrés).
- Cortisol en orina de 48-72 horas: indica la secreción integrada de cortisol.
- Cortisolemia durante el día y su relación con el ritmo circadiano: se pierde relación con el ritmo en la hipercortisolemia.
- Determinación de enzimas como la 11-desoxicortisol o 17-hidroxiprogesterona en plasma: estas enzimas derivan del colesterol a las hormonas suprarrenales.
- Pruebas de estimulación: valoran la hipofunción glucocorticoide, ej. La administración de ketoconazol, tetracosáctido, metopirona medición de anticuerpos para las enzimas suprarrenales.
- Pruebas de supresión: valoran la hiperfunción glucocorticoide, ej. La prueba de Nugent y la administración de dexametasona.
Función mineralocorticoide
- Determinación de aldosterona y A-II en plasma u orina: si ambas están elevadas hay un hiperaldosteronismo secundario y si la aldosterona esta elevada y la A-II disminuida hay un hiperaldosteronismo primario.
- Actividad de renina plasmática: mide la actividad de la A-II
- Furosemida VIV: en personas sanas disminuye la volemia, aumenta la aldosterona y aumenta la A-II (angiotensina), si la A-II desciende hay un hiperaldosteronismo primario.
Función androgénica suprarrenal
- Determinación de sulfato de dehidropiandrosterona en sangre: valora la secreción de andrógenos.
- Respuesta androstenediona y dehidroepiandrosterona al tetracosáctido: valora la respuesta androgénica.
Exploración anatómica de las glándulas suprarrenales
Se realiza mediante ecografía, TAC (tomografía axial computarizada), RMN (resonancia magnética). La gammagrafía con colesterol marcado con yodo radioactivo da una imagen de la anatomía funcional de la corteza suprarrenal, ya que es captado selectivamente por ella.
Síndromes de hipofunción corticosuprarrenal
Son los síndromes producidos por una insuficiente actividad de las hormonas corticosuprarrenales sobre sus órganos diana. La hipofunción suprarrenal puede ser: global, selectiva, mixta, aguda y crónica (enfermedad de Addison).
Síndrome de insuficiencia suprarrenal global
Etiopatogenia
Insuficiencia suprarrenal primaria
Se debe a una enfermedad intrínseca de las suprarrenales. Las causas más frecuentes son la tuberculosis y la adrenalitas autoinmunitaria. La tuberculosis destruye la corteza y la médula y provoca una deficiencia hormonal global. La adrenalitas autoinmunitaria afecta solamente a la corteza, sin que se produzca destrucción de la médula. También son causas los hongos, CID, amiloidosis, cirugías, fármacos que inhiben las enzimas que sintetizan el cortisol (ketoconazol), SIDA y enfermedades congénitas.
Se caracteriza porque hay un déficit de glucocorticoides y además de mineralocorticoides, lo que hace la diferencia con la insuficiencia suprarrenal secundaria y terciaria, donde la deficiencia es solo de glucocorticoides, ya que los mineralocorticoides (aldosterona) se mantienen indemne gracias a su regulación de feed-back corto por medio del sistema renina-angiotensina, la presión arterial, la concentración de potasio, y en menor medida la estimulación de ACTH.
Insuficiencia suprarrenal terciaria
Se debe a un trastorno hipotalámico en la producción y secreción de CRH.
Resistencia familiar a los glucocorticoides
Algún trastorno de un gen que sintetiza la proteína receptora de los glucocorticoides.
Fisiopatología
Insuficiencia suprarrenal primaria

Cuando se produce una destrucción lenta de las suprarrenales, a medida que la secreción de cortisol y aldosterona va bajando se eleva de forma compensadora la ACTH (hormona adrenocorticotropa o corticotropina), con lo que se mantiene la secreción hormonal, aunque la reserva suprarrenal baja. El paciente puede hacer una vida normal pero cualquier estrés puede desencadenar una insuficiencia suprarrenal aguda.
Cuando el 90% de la glándula se ha destruido se produce una insuficiencia suprarrenal global debido a que los mecanismos compensadores son incapaces de mantener unos niveles adecuados de esteroides. El exceso de ACTH, va a ser provocado por un exceso de POMC (precursora de la ACTH y la MSH), ésta última estimula a los melanocitos y causa una hiperpigmentación en áreas expuestas como cara cuello y manos, roce o presión en las rodillas, codos, áreas de sostén, cintura, labios y mucosa oral.
La falta de cortisol provoca una disfunción celular generalizada que se va a manifestar con cansancio y debilidad muscular, gastrointestinalmente se manifiesta como náuseas, vómitos, diarrea (deshidratación), se causa una hipoglucemia por la disminución de la gluconeogénesis y el aumento a la sensibilidad de la insulina y finalmente una mala tolerancia al estrés.
La falta de mineralocorticoides causa un aumento de las pérdidas urinarias de sodio, una retención renal de potasio (hiponatremia e hiperpotasemia), que causa astenia y alteraciones neuromusculares, además por la depleción hidrosalina causa una hipotensión ortostática que progresa a una hipotensión arterial, a su vez la retención de hidrógeno va a causar una acidosis hiperclorémica.
La falta de andrógenos suprarrenales en la mujer va a disminuir la presencia de vello axilar y pubiano, con disminución de la libido; en el hombre va a disminuir la libido y afecta a la función inmunológica y a la calidad de vida.
Insuficiencia suprarrenal secundaria o terciaria
Se diferencian de la anterior en que no se produce hiperpigmentación (debido a que las concentraciones de ACTH son indetectables), las alteraciones hidroelectrolíticas son menores (ya que la aldosterona esta relativamente conservada por el sistema renina-angiotensina) y pueden aparecer otros datos de enfermedad hipofisiaria o hipotalámica.
Insuficiencia suprarrenal aguda
La ausencia repentina de cortisol y aldosterona provoca náuseas, vómitos, dolor abdominal, hiperpotasemia e hipoglucemia. Es mortal si no se trata inmediatamente.
Síndrome de hipoaldosteronismo aislado
Etiopatogenia
Hipoaldosteronismo debido a falta de angiotensina
Puede ser hiperreniémico que aparece en pacientes que usan IECA o ARA-II; y puede ser hiporreniémico por un defecto en el aparato yuxtaglomerular (diabetes mellitus + IRC).
Pseudoaldosteronismo
Se debe a resistencia de los órganos diana a los efectos de la aldosterona, que realmente se encuentra elevada en sangre, puede ser congénita (por mutación del receptor).
Fisiopatología
Las consecuencias de la falta de aldosterona ya se ha explicado anteriormente.
Síndromes mixtos de hipofunción e hiperfunción suprarrenal
El más frecuente combina hipocortisonismo, hipoaldosteronismo e hiperandrogenismo. Aparece en la hiperplasia suprarrenal congénita, la incapacidad para producir cortisol provoca una elevación de los niveles de ACTH e induce un crecimiento difuso de las suprarrenales y estimula en exceso la síntesis de andrógenos.
Síndromes de hiperfunción corticosuprarrenal
Síndrome de hipercortisolismo
Excesiva actividad de los glucocorticoides sobre las células del organismo (si es un problema crónico, se denomina síndrome de Cushing).
Etiopatogenia
- Primario: adenoma suprarrenal, CA suprarrenal, hiperplasia suprarrenal (no por ACTH).
- Secundario: microadenoma hipofisiario secretor de ACTH (Cushing).
- Terciario: hipersecreción hipotalámica de CRH (tumoral o no).
- Secreción ectópica de ACTH (CA bronquial).
- Secreción ectópica de CRH (carcinoide).
- Yatrógeno: uso crónico de ACTH o cortisol.
Fisiopatología
El exceso crónico de corticoides produce una redistribución de la grasa corporal y un aumento del catabolismo proteico. La grasa tiende a acumularse en la cara, el cuello, el tronco y el abdomen, las extremidades adelgazan, ya que pierden tejido adiposo, los músculos se atrofian debido al catabolismo proteico. Todo ello configura una obesidad de localización troncular o central. La cara adquiere un aspecto redondeado ("en luna llena"), el cuello se ve relativamente corto ("cuello de búfalo"), debido al acúmulo de grasa y una fosa supraclavicular prominente.
En los niños, el estado catabólico provoca una detención del crecimiento, y otras manifestaciones pueden ser: piel atrófica y débil, mala cicatrización, estrías purpuritas o vinosa, osteoporosis. Aparece intolerancia a la glucosa e hiperinsulinismo, que pueden desencadenar una diabetes mellitus. En el sistema nervioso, produce depresión, paranoia. Puede aparecer HTA que puede desencadenar ICC.
En los casos donde se ve elevada la ACTH, se puede encontrar hiperpigmentación y aumento de las secreción de andrógenos, lo que se traduce en hirsutismo e irregularidades menstruales.
Síndrome de hipermineralocorticismo
Hiperaldosteronismo primario o síndrome de Conn
Etiopatogenia
- Tumor adrenal secretor de aldosterona (c, carcinoma).
- Hiperplasia de la capa glomerulosa
- Hiperaldosteronismo primario familiar: síndrome de Sutherland, donde ocurre una síntesis ectópica de aldosterona en la capa fasciculada.
Fisiopatología
El exceso de aldosterona produce un aumento de retención de sodio en el riñón, con expansión del volumen circulante e HTA de grado variable. El exceso de volemia causa inhibición en la formación de renina y activa la secreción de diversos péptidos diuréticos (fenómeno de escape), debido a este fenómeno rara vez se presenta edema. Otra consecuencia del exceso de aldosterona es una hipopotasemia (por hiperkaliuria), ésta puede modificarse en una alcalosis metabólica y un aumento de la resistencia tubular a ADH (poliuria) y debilidad muscular.
Hiperaldosteronismo secundario (hiperreninémico)
Etiopatogenia
Se da en todas aquellas situaciones en que aumenta la concentración de renina en la sangre, lo que origina un aumento de la angiotensina II que estimula la producción de aldosterona y eso se produce por: disminución del volumen circulante o alteraciones renales.
Fisiopatología
El hiperaldosteronismo produce una retención renal de sodio y perdida de potasio. esto causa una expansión del volumen extracelular y plasmático con formación de edemas;cabe destacar que la TA es normal o baja.
Historia
Se dice que Bartolomeo Eustachi, anatomista italiano, hizo la primera descripción de las glándulas suprarrenales, en 1563-1564.[2][3] Sin embargo, estas publicaciones estaban incluidas en la Biblioteca Apostólica Vaticana, y la opinión pública no les prestó la atención que, en cambio, sí recibieron las ilustraciones de Caspar Bartolino el Viejo, de 1611.[4]
Las glándulas suprarrenales se llaman así debido a que se encuentran encima de los riñones. El término adrenal proviene del latín ad-, "cerca", y renes, "riñón".[5] El término suprarrenal, denominado así por Jean Riolan el Joven en 1629, proviene del latín supra, "encima", y renes, "riñón". El hecho de que se trataba de glándulas localizadas encima de los riñones se aceptó en el siglo XIX, cuando los anatomistas confirmaron que no existen ductos y que muy probablemente su función era secretoria; antes de que se confirmaran esos datos, había un debate respecto a si las glándulas eran realmente suprarrenales o si formaban parte de los riñones.[6]
Una de las obras más reconocidas acerca de las glándulas suprarrenales fue On the Constitutional and Local Effects of Disease of the Suprarenal Capsule [Sobre los efectos constitucionales y locales de la enfermedad de la cápsula suprarrenal], publicaa en 1855 poor el médico inglés Thomas Addison. En esta monografía, el autor describe lo que más adelante el médico francés Georges Phillipe Trousseau denominaría enfermedad de Addison, epónimo que sigue utilizándose para la insuficiencia adrenal y las manifestaciones clínicas relacionadas.[7] En 1894, los fisiólogos británicos George Oliver y Edward Albert Sharpey-Schafer estudiaron la acción de los extractor adrenales y observaron sus efectos antihipotensivos o vasopresores. En las décadas siguientes, varios médicos experimentaron con extractos de la corteza suprarrenal para tratar la enfermedad de Addison.[8][9] Edward Calvin Kendall, Philip Showalter Hench y Tadeusz Reichstein recibieron en 1950 el Anexo:Ganadores del Premio Nobel de Fisiología o Medicina, por sus descubrimientos acerca de la estructura y los efectos de las hormonas adrenocorticales.[10]
Véase también
Referencias
- ↑ Kay, Saundra M (en inglés) «Adrenal Glands: Anatomy» Medscape. Consultado el 6 de noviembre de 2015.
- ↑ Schmidt, JE (1959). Thomas, ed. Medical Discoveries: Who and When. pp. 9-10.
- ↑ O'Hare, A. Munro Neville, Michael J. (2012). Springer London, ed. The Human Adrenal Cortex Pathology and Biology -- An Integrated Approach. Londres. pp. Chapter 2: Historical Aspects. ISBN 1447113179.
- ↑ O'Hare, A. Munro Neville, Michael J. (2012). Springer London, ed. The Human Adrenal Cortex Pathology and Biology -- An Integrated Approach. Londres. pp. Capítulo 2: Historical Aspects (Aspectos históricos). ISBN 1447113179.
- ↑ About.com (ed.). «What Are The Adrenal Glands?». Consultado el 18 de septiembre de 2013.
- ↑ O'Hare, A. Munro Neville, Michael J. (2012). Springer London, ed. The Human Adrenal Cortex Pathology and Biology -- An Integrated Approach. Londres. pp. Capítulo 2: Historical Aspects (Aspectos históricos). ISBN 1447113179.
- ↑ Pearce, JM (2004). «Thomas Addison (1793-1860)». Journal of the Royal Society of Medicine 97 (6): 297-300. PMC 1079500. PMID 15173338. doi:10.1258/jrsm.97.6.297.
- ↑ Schmidt, JE (1959). Thomas, ed. Medical Discoveries: Who and When. pp. 9-10.
- ↑ O'Hare, A. Munro Neville, Michael J. (2012). Springer London, ed. The Human Adrenal Cortex Pathology and Biology -- An Integrated Approach. Londres. pp. Chapter 2: Historical Aspects. ISBN 1447113179.
- ↑ Nobel Foundation (ed.). «The Nobel Prize in Physiology or Medicine 1950». Consultado el 10 de febrero de 2015.
Bibliografía
- García-Conde, J.: Patología general, semiología clínica y fisiopatología.
Enlaces externos
 Wikimedia Commons alberga una galería multimedia sobre Glándula suprarrenal.
Wikimedia Commons alberga una galería multimedia sobre Glándula suprarrenal. Wikcionario tiene definiciones y otra información sobre glándula suprarrenal.
Wikcionario tiene definiciones y otra información sobre glándula suprarrenal.
