Líquido iónico

Un líquido iónico (LI) es un fluido constituido exclusivamente por iones, considerándose como tales a las sales con una temperatura de fusión por debajo del punto de ebullición del agua (100 °C al nivel del mar, ya que varía de acuerdo a la presión atmosférica) y que a menudo son hidrolíticamente estables.
La composición química general de estos materiales es sorprendentemente consistente, incluso aunque la composición específica y las propiedades físicas y químicas varían tremendamente. La mayoría tiene una estructura compuesta por un catión orgánico y un anión inorgánico poliatómico. Debido a que hay muchos y muy conocidos cationes y aniones, el número potencial de LI es enorme, del orden de millones de combinaciones posibles. Descubrir un nuevo tipo de líquido iónico es relativamente fácil, pero determinar aplicaciones de los líquidos iónicos requiere una inversión mucho más sustancial en la determinación de sus propiedades físicas y químicas.
Los primeros LI inicialmente fueron desarrollados para ser usados como electrolito, aunque debido a sus propiedades: una volatilidad prácticamente nula, con una presión de vapor casi cero ya que están compuestos completamente de iones; inflamabilidad despreciable; un amplio rango de líquidos, es decir, una alta estabilidad térmica y un bajo punto de fusión; y una miscibilidad controlada con los compuestos orgánicos; este tipo de materiales ha ido ganando importancia y un particular interés como un nuevo tipo no convencional de disolvente (disolvente verde), en especial por su nula volatilidad, que permite no considerar a estas sustancias como compuestos orgánicos volátiles (COV).
Estructura
[editar]Un líquido iónico está formado por iones muy asimétricos y voluminosos, por lo que presenta fuerzas atractivas más débiles que las sales iónicas convencionales.
Por lo general, poseen una estructura compuesta por un catión orgánico, que contiene un heteroátomo (N o P), asociado a un anión mineral u orgánico de elevado tamaño, entre los cationes más comunes se destacan: [bmin]+(1-butil-3-metil imidazolio), [hmim]+ (1-hexil-3-metil-imidazolio), [omim]+(1-octil-3-metil-imidazolio), [beim]+ (1-butil-3-etil-imidazolio), [emim]+ (1-etil-3-metil-imidazolio), etc.
 |
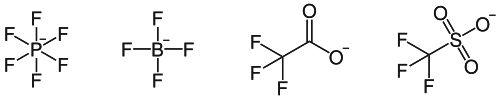
Entre los aniones más usuales se encuentran: PF6-(Hexafluorofosfato), BF4-(Tetrafluoroborato), CF3-COO-(Trifluoroacetato), CF3-SO3-(Trifluorosulfonato o Triflato), SbF6-(Hexafluoro Antimoniato), etc.
 |
El tetrafluoroborato de 1-butil-3-metilimidazolio, el cloruro de 1-butil-3-metilimidazolio y el hexafluorofosfato 1-butil-3-metilimidazolio son algunos ejemplos de líquidos iónicos.
Propiedades
[editar]Entre las propiedades más interesantes de los líquidos iónicos se pueden destacar:
- Bajo punto de fusión ( son líquidos a temperatura ambiente).
- Presión de vapor muy baja ( no son volátiles).
- Alta estabilidad térmica, en muchos casos supera los 300 °C. Por encima de esta temperatura suelen descomponerse.
- Alto calor específico.
- Alto poder disolvente de distintas materias orgánicas, inorgánicas y poliméricas, polares y no polares.
- Elevada estabilidad química.
- Poseen acidez tipo Brønsted o Lewis y superacidez .
- Elevada conductividad iónica.
- Buenas propiedades electroquímicas.
- Elevada viscosidad entre 10-500 cP.
- Elevada densidad.
- pH variable encontrándose LI ácidos, neutros o básicos.
- ¿¿¿No inflamables???(Ver Referencia 11), no corrosivos.
- Potentes catalizadores.
- Fácilmente reciclables.
- Incoloros en estado puro.
Aplicaciones industriales (Ejemplos)
[editar]Los líquidos iónicos (LI) pueden considerarse como nuevos disolventes debido a sus propiedades: baja inflamabilidad, baja o nula volatilidad, estabilidad térmica y alta conductividad iónica. Por esta razón, sus principales aplicaciones serían sustituyendo a los disolventes orgánicos convencionales en reacciones bifásicas y en procesos de separación
- Separación líquido - líquido
- Separación sólido - líquido
- Separación de iones metálicos
Además, se pueden utilizar en otras aplicaciones como en la extracción con fluidos supercríticos o en el desarrollo de nuevos procesos tecnológicos e industriales.
Proceso BASIL
[editar]BASIL (Biphasic Acid Scavenging utilising Ionic Liquids) es un proceso industrial desarrollado por BASF para la formación de alcoxifenilfosfinas mediante la siguiente reacción química:
En esta reacción se forma un líquido iónico inmiscible que se separa de la mezcla y puede volver a utilizarse en el siguiente ciclo del proceso. Este es uno de los más importantes ejemplos del uso de líquidos iónicos a nivel industrial, en el cual se producen toneladas de producto, con rendimientos del 98%. Recibió el premio ECN de innovación en el año 2004.
Otros procesos desarrollados por BASF:
- Cloración de alcoholes reemplazando el fosgeno como agente de cloración por ácido clorhídrico (HCl). Éste actúa como nucleófilo dando lugar a cuatro compuestos distintos, mientras que disuelto en un líquido iónico se obtiene el producto clorado puro.
- Rotura de mezclas azeotrópicas, que los líquidos iónicos pueden actuar como auxiliares mejorando la separación, por ejemplo en mezclas agua-etanol y agua-tetrahidrofurano.
Proceso Difasol
[editar]Se basa en la dimerización de alquenos, generalmente propeno y buteno, a hexeno y octeno. Es un proceso muy importante desarrollado por el Institut Franςais du Pétrole (IFP), utilizando un líquido iónico como disolvente y un catalizador de níquel. La reacción se lleva a cabo mediante un sistema bifásico donde los productos se quedan en una segunda fase y se separan fácilmente. El catalizador queda disuelto en la fase líquido iónico.
Aditivos para pinturas
[editar]Degussa, utiliza líquidos iónicos como aditivos en la fabricación de nuevas pinturas, con el objetivo de mejorar el acabado, la apariencia y las propiedades de secado. Esto permite la reducción del uso de sustancias orgánicas volátiles.
Otra aplicación, en la cual Degussa investiga, es en el uso de LI en baterías de litio como electrolitos.
Síntesis de fármacos
[editar]Central Glass Company sintetiza intermedios farmacéuticos mediante la reacción de acoplamiento de Sonogashira. Utilizan un líquido iónico como medio de reacción sustituyendo a los disolventes tradicionales como tolueno o tetrahidrofurano.
Otro proceso es la desmetilación de arileter para la generación de fenoles que se presenta a continuación:
Esta reacción ha sido desarrollada por Eli Lilly, compañía farmacéutica, y llevada a escala de planta piloto para producir estos intermedios farmacéuticos
Recuperación
[editar]Desde el punto de vista medioambiental así como económico, la recuperación de líquidos iónicos (LI) mediante la tecnología de membrana (nanofiltración) es del todo interesante por tener estos compuestos alto valor añadido en la industria la cual los utilice, ser más beneficioso para el medio ambiente y ser la opción más cómoda, ya que es un equipo que podemos adquirir en el mercado (no así uno de tecnología de adsorción). Con esta opción se recupera el líquido iónico y no se generan residuos de carbón activo. La nanofiltración, además, presenta altos niveles de retención siendo su consumo de energía no muy alto [10]. Respecto a pruebas experimentales de adsorción del LI sobre carbón activo, se ha visto que esta, se trata de otra técnica interesante de recuperación de los LI. [10]
Toxicidad
[editar]Los LI tienen varias propiedades para ser seleccionados como candidatos a disolventes verdes, porque al utilizarlos presentan beneficios para el ambiente entre ellos se destaca la disminución de emisiones atmosféricas al eliminar pérdidas de disolvente por evaporación, y la reducción de residuos debido a que estos pueden ser reutilizados. Igualmente, al eliminar la etapa de evaporación del disolvente se reduce el consumo energético. También es posible el diseño de LI no tóxicos y biodegradables mediante la adecuada selección del catión y el anión.
Aunque los LI evitan la contaminación atmosférica que originan los disolventes tradicionales, su relativa solubilidad en fase acuosa puede causar problemas de contaminación del agua y por ende problemas a los seres vivos, sin embargo, para un uso seguro de los LI se hace necesario conocer su toxicidad y biodegradabilidad.
Aunque los datos que se tienen no han sido determinados para muchos LI, la volatilidad prácticamente nula de estos reduce las potenciales vías de exposición, siendo el contacto directo con la piel y la ingestión prácticamente las únicas vías posibles. Es adecuado resaltar que se han realizado diferentes ensayos y estudios para determinar la toxicidad y la biodegradabilidad de los LI, donde se muestra que algunos de estos pueden ser tóxicos así como bastante inofensivos y biodegradables, sin embargo, la mayoría de los LI que se han investigado son irritantes y tienen una toxicidad comparable a los disolventes orgánicos convencionales.
Toxicidad in vitro
[editar]Estos ensayos han demostrado actividad inhibidora de la acetilcolinesterasa; esta inhibición depende de la longitud de la cadena alquílica del catión y poco del anión, la mayor actividad inhibidora se da con cadenas alquílicas largas.
Los ensayos in vitro solo dan indicaciones del peligro potencial, pero no implican que deba haber un efecto sobre un organismo completo, para ello debe contarse con datos de transporte (sobre todo a través de membranas biológicas) y de bioacumulación.
Según el coeficiente de reparto octanol/agua (Kow) la solubilidad en octanol de los LI aumenta con la longitud de la cadena alquílica del catión.
Toxicidad en microorganismos
[editar]La toxicidad frente a microorganismos es muy notable en algunos casos y depende de la longitud de la cadena alquílica (lo que se relaciona con el coeficiente de reparto). Los LI con cationes con cadena alquílica larga provocan la pérdida del flagelo de los microorganismos que lo poseen e igualmente generan un efecto inhibitorio en el crecimiento de los mismos. El efecto tóxico de LI varía mucho con el microorganismo utilizado.
Toxicidad en células
[editar]En células del epitelio la citotoxicidad de los LI que se han ensayado han mostrado que esta aumenta con el tiempo de exposición. En células de carcinoma de colon como HT-29 y CaCo-2, la citotoxicidad aumenta con la longitud de la cadena alquílica del catión del LI, pero también depende del anión (por ejemplo el anión hexafluorofosfato aumenta la toxicidad);aunque la influencia del anión no es clara, parece ser mucho menor a la del catión.
En general, la citotoxicidad aumenta con la longitud de la cadena alquílica del catión, llegando incluso a ser superior que la presentada por los disolventes orgánicos convencionales como: acetonitrilo, acetona, benceno, tolueno, fluorobenceno, metanol, ácido acético, diclorometano y xileno.
Toxicidad en organismos
[editar]Organismos como caracoles de agua dulce, ratas, peces ( pez cebra), expuestos a algunos LI basados en cationes imidazolio y pirimidina han presentado alteraciones estructurales y bioquímicas, en general los LI han afectado su movimiento, causando pérdidas de equilibrio y una marcada tendencia a permanecer inmóviles, además han generado la disminución en su crecimiento al comparase con los organismos testigo. Igualmente para este caso la toxicidad aumenta también con la longitud de la cadena alquílica del catión.
Un estudio realizado utilizando Berro (Lepidium sativum) determina que los LI a base de cationes imidazolio generan una ligera toxicidad a esta planta comestible, debido a una disminución en su crecimiento al ser comparado con otras sustancias tales como el fenol y sulfato de zinc.
Enlaces externos
[editar]- Ionic liquids Merck Archivado el 5 de marzo de 2012 en Wayback Machine.
Referencias
[editar]- Evans-White, Lamberti, G., A,. Environ Toxicol Chem. 2009, 28:2, 418-426.
- Lei, Z., Chen, B., Li, C., Liu, H,. Chem. Rev., 2008, 108, 1419-1455.
- Matzke, M., Stolte, S., Thiele, K., Juffernholz, T., Arning, J., Ranke, J., Urs Welz-Biermann, Bernd Jastorff., Green Chem., 2007, 9, 1198–1207.
- Plechkova, N.V., Seddon,K.R., Chem. Soc. Rev., 2008, 37, 123-150.
- Seki, S., Kobayashi, Y., Ohno, Y., Usami, A., Mita, Y., Watanabe, M., Terada, N., Chem. Comm., 2006, 544-545.
- Studzinka, S., Buszewski, B. Anal. Bioanal. Chem., 2009, 393:983-990.
- Torrecilla, J. S., García, J., Rojo, E., Rodríguez, F., J.Hazard Mater., 2008, doi:10.1016/j.jhazmat.2008.08.022
- Wasserscheid, P., Welton, T,. (2008). Ionic Liquids in Synthesis. Wiley-VCH. ISBN 978-3-527-31239-9. (en inglés)
- Zhao, D., Liao, Y., Zhang, Z., Review. Clean 2007, 35 (1), 42 – 48.
- Fernández, J.F., Atalaya Solís, P., Virtual Pro 2013, 137, 13.
- Marcin Smiglak,a W. Mathew Reichert,a John D. Holbrey,{a John S. Wilkes,*b Luyi Sun, aJoseph S. Thrasher,a Kostyantyn Kirichenko,c Shailendra Singh,c Alan R. Katritzkyc and Robin D. Rogers*a "Combustible ionic liquids by design: is laboratory safety another ionic liquid myth?" www.rsc.org/chemcomm


