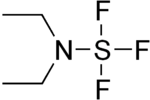Trifluoruro dietilaminoazufre
| trifluoruro de dietilaminoazufre | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| N,N-Dietilaminosufluro trifluoruro | ||
| General | ||
| Otros nombres |
trifluoruro de dietilaminoazufre DAST | |
| Fórmula semidesarrollada | (CH3CH2)2NSF3 | |
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 38078-09-0[1] | |
| Propiedades físicas | ||
| Apariencia | aceite incoloro | |
| Densidad | 1220 kg/m³; 1,22 g/cm³ | |
| Masa molar | 161,18 g/mol | |
| Riesgos | ||
| Riesgos principales | Muy peligroso, puede ser explosivo | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El trifluoruro de dietilaminoazufre (DAST) es un compuesto de organoazufre de fórmula Et2NSF3. Este líquido es una fluoración reactivo utilizado para la síntesis de compuestos organofluorados. El compuesto es incoloro; en grandes muestras puede prsentar un color naranja.
Empleo en síntesis orgánica[editar]
El DAST convierte los alcoholes a los fluoruros de alquilo correspondiente, así como aldehídos y cetonas sin obstáculos a difluoruros geminales. Los ácidos carboxílicos reaccionan hasta el fluoruro de acilo (el tetrafluoruro de azufre efectúa la transformación -CO2H → -CF3 ). El DAST se utiliza preferentemente al más clásico tetrafluoruro de azufre SF4 gaseoso, ya que como líquido, es más fácil de manejar. Las temperaturas de reacción son más suaves: los alcoholes reaccionan normalmente a -78 °C y las cetonas alrededor de 0 °C.
Síntesis[editar]
El DAST se prepara mediante la reacción de tetrafluoruro de azufre y dietilaminotrimetilsilano:[2]
- Et2NSiMe3 + SF4 → Et2NSF3 + Me3SiF
El protocolo de síntesis orgánica exige triclorofluorometano como disolvente, un compuesto prohibido por el Protocolo de Montreal y ya no está disponible como producto químico. Se puede utilizar éter etílico en su lugar sin ninguna disminución de rendimiento.[3] Debido a los peligros involucrados en la preparación de DAST (grabado de vidrio, posibilidad de eventos exotérmicas), a menudo se adquirió de una fuente comercial. En un momento Carbolabs[4] fue uno de los pocos proveedores de la industria química, sino una serie de compañías ahora venden DAST.
Seguridad y reactivos alternativos[editar]
En contacto con el agua, cuando se calienta por encima de 90 °C y a una destilación tempestuosa puede experimentar una descomposición explosiva puede ocurrir. Tras el calentamiento, el DAST se convierte a SF4 y (NEt2)2SF2, un compuesto de alto punto de ebullición y explosivo. Para minimizar el peligro de accidentes, se debe mantener por debajo de 50 °C., así como en solución.[5] En caso de contacto con la piel o los ojos de líquido inflamable son posibles quemaduras graves.[6]
El Bis - (2-metoxietil) aminosulfur trifluoruro es un reactivo térmicamente más estable.
Véase también[editar]
Referencias[editar]
- ↑ Número CAS
- ↑ W. J. Middleton, E. M. Bingham "Diethylaminosulfur Trifluoride” Organic Syntheses, Coll. Vol. 6, p.440; Vol. 57, p.50. Online version
- ↑ L. N. Markovskij, V. E. Pashinnik, and A. V. Kirsanov (1973). Synthesis (787).
- ↑ REACTION OF SULFOXIDES WITH DIETHYLAMINOSULFUR TRIFLUORIDE: FLUOROMETHYL PHENYL SULFONE, A REAGENT FOR THE SYNTHESIS OF FLUOROALKENES Archivado el 20 de septiembre de 2012 en Wayback Machine., Organic Syntheses, Coll. Vol. 9, p.446 (1998); Vol. 72, p.209 (1995)
- ↑ P. G. Urben(Hrsg.): Bretherick’s handbook of reactive chemical hazards. Volume 1 7. Auflage, Surendra-Kumar-Verlag/Elsevier, 2007, ISBN 978-0-12-373945-2, S. 641.
- ↑ Base de datos dietilaminoazufre en Merck,