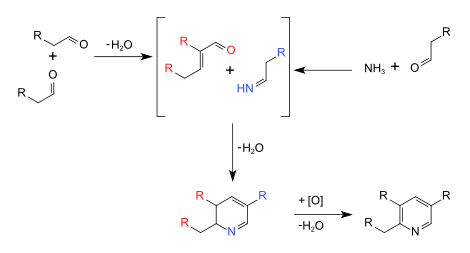
Síntesis de piridina de Chichibabin
La Síntesis de piridina de Chichibabin es un método para sintetizar anillos de piridina. En su forma general, la reacción puede ser descripta como una reacción de condensación entre aldehídos, cetonas o compuestos Carbonilos α,β-Insaturados o cualquier combinación de los anteriores, en amoníaco o en otros derivados del amoníaco.[1] La reacción fue publicada por Alekséi Chichibabin en 1924.[2] La siguiente imagen muestra la forma general de la reacción:

Mecanismo de reacción
[editar]Los pasos elementales del mecanismo de reacción pueden ser clasificados como reacciones más conocidas, como una síntesis de iminas, una condensación aldólica catalizada por bases y una reacción de Michael. Entonces, los pasos elementales en la reacción son los siguientes:
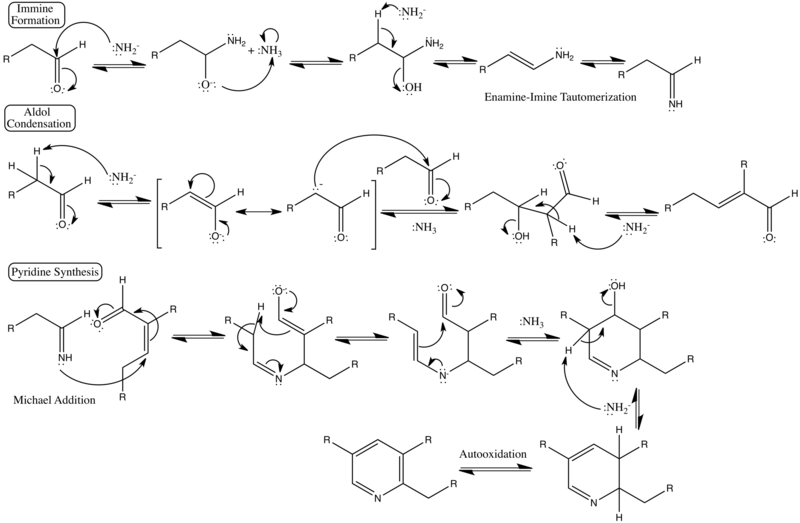
Mecanismo de reacción detallado
[editar]Mecanismo que muestra análiticamente los distintos pasos de la reacción y sus desplazamientos electrónicos.[3][4]
Aplicaciones sintéticas
[editar]Las piridinas alquil-subtituidas muestran un amplio espectro de usos en variados campos de la química aplicada como así también en la industria de polímeros y en la industria farmacéutica. Por ejemplo la 2-metilpiridina, 4-metilpiridina y el 2-etil-5-metilpiridina son usados en la síntesis de diferentes látex, matrices de intercambio iónico y materiales fotográficos.[5]
Limitaciones
[editar]Una de las principales limitaciones en la aplicación práctica de la tradicional síntesis de Chichibabin es su bajo rendimiento. Con la excepción de dos experimentos, el mismo Chichibabin fue incapaz de obtener rendimientos mayores al 20% aún usando una gran variedad de reactivos, solventes y otras condiciones experimentales. Esto, sumado a la alta ocurrencia de productos derivados que requieren de múltiples pasos de purificación para aíslar la piridina pura hace que el método de Chichibabin sea poco viable para la química aplicada.[1][2]
La alta proporción de productos derivados y el bajo rendimiento se explican por la naturaleza fácilmente reversible de la condensación aldólica, y la química del grupo carbonilo en general.[1] Por ejemplo, los productos derivados se pueden dar por las siguientes reacciones secundarias:
En los pasos de la formación de la imina
1.El ataque nucleófilo del amoníaco en el carbono beta en vez del carbono alfa inhibe la formación del producto enamina/imina.
2.Atáque nucleófilo del amoníaco en la enamina o la imina.
En los pasos de la condensación aldólica
3.(En el caso de cetonas asimétricas) Ocurre la abstracción del no-preferido hidrógeno beta.
4.Ataque del anión enolato al carbono de la enamina o de la imina.
5.Ataque del anión enolato a un otro aldehído o a un ceto-carbonílico.
En los pasos de la síntesis de la piridina
6. Ataque de la imina a un carbonilo en vez del ataque al carbono γ.
7. Ataque de la imina a la enamina o al carbono imínico.
En el caso de aldehídos simples y particularmente en el caso de compuestos carbonílicos α,β-insaturados, ocurre frecuentemente la polimerización de los reactivos iniciales resultando en una disminución de los productos finales.[1]
Vías para evitar las limitaciones de la síntesis
[editar]1. La protección del grupo carbonilo incrementa el rendimiento del producto.[1]
2. Uso de paraldehído como fuente graduada de acetaldehído.[1]
3. Una gran cantidad en exceso de amoníaco acuoso (más de tres veces su cantidad catalítica), con cantidades catalíticas de acetato de amonio.[1][4]
4. Realizar la reacción en fase gaseosa sobre una serie de catalizadores como alúmina (rendimiento de 65% a 600 K),[5] zeolita (rendimiento de 98,9% a 500 K),[6] y otros más.
5. Realizar la reacción a presión y temperatura alta.[1][4]
Evidencia in-vivo de este mecanismo
[editar]La desaminación in vivo grupo α-amino de un aminoácido produce pequeñas cantidades de amoníaco. Los investigadores encontraron que la al-lisina (lisina desaminada) del ligamento nucal bovino en fibras de elastina estaban al parecer entrecruzadas mediante piridina. Las estructuras de estos aminoácidos entrecruzados tenían 3,4,5- y 2,3,5- piridinas trisustituidas, específicamente en la desmosina (DESP)y en la isodesmosina (IDP).[7]
Exrapolando lo anterior a un modelo in vitro de elastina bajo condiciones fisiológicas, los investigadores encontraron que el cociente IDP/DESP correspondiente es extremadamente cercano a los valores obtenidos y basados en cálculos teóricos de la reacción de síntesis de piridinas de Chichibabin entre tres moles de al-lisina y un mol de amoníaco, obteniendo cocientes de piridinas tri-sustuídas 2,3,5-/3,4,5- en una reacción que involucra fenilacetaldehído.[8] Concluyeron entonces con relativa certeza que los entrecruzamientos de piridina encontrados en la elastina son, de hecho, debidos a una reacción de síntesis de piridina de Chichibabin entre amoníaco y al-lisina.[7]
Reacciones relacionadas
[editar]- Reacción de Chichibabin
- Síntesis de Gattermann-Skita[9]
- Síntesis de piridina de Hantzsch
- Transposición de Ciamician-Dennstedt[10]
Referencias
[editar]- ↑ a b c d e f g h Frank, R.L.; Seven, R. P. (1949). «Pyridines. IV. A Study of the Chichibabin Synthesis». Journal of the American Chemical Society 71 (8): 2629-2635. doi:10.1021/ja01176a008.
- ↑ a b Tscihtschibabin, A.E. (1924). «Über Kondensation der Aldehyde mit Ammoniak zu Pyridinebasen». Journal für praktische Chemie 107: 122. doi:10.1002/prac.19241070110.
- ↑ Jie Jack Li (2009). «Chichibabin pyridine synthesis». Name Reactions. pp. 107–109. ISBN 3540402039. doi:10.1007/978-3-642-01053-8_51.
- ↑ a b c M Weiss (1952). «Acetic Acid—Ammonium Acetate Reactions. An Improved Chichibabin Pyridine Synthesis». Journal of the American Chemical Society 74 (1): 200. doi:10.1021/ja01121a051.
- ↑ a b Sagitullin, R.S.; Shkil, G.P.; Nosonova, I.I.; Ferber, A.A. (1996). Chichibabin pyridine synthesis. «Synthesis of pyridine bases by the Chichibabin method (review)». Chemistry of Heterocyclic Compounds 32 (2): 127-140. doi:10.1007/BF01165434.
- ↑ Krishna Mohan, K.V.V.; Reddy, K.S.K.; Narender, N.; Kulkarni, S.J. (2008). «Zeolite catalysed synthesis of 5-ethyl-2-methylpyridine under high pressure». Journal of Molecular Catalysis A: Chemical 298 (1–2): 99-102. doi:10.1016/j.molcata.2008.10.010.
- ↑ a b Umeda, H; Takeuchi, M.; Suyam, K (2001). «Two New Elastin Cross-links Having Pyridine Skeleton». Journal of Biological Chemistry 276 (16): 12579-12587. PMID 11278561. doi:10.1074/jbc.M009744200.
- ↑ Farley, C.; Eliel, E. (1956). «Chichibabin Reactions with Phenylacetaldehyde. II». Journal of the American Chemical Society 78 (14): 3477-3484. doi:10.1021/ja01595a057.
- ↑ Gattermann,L; Skita, A. (1916). «Eine Synthese von Pyridin-Derivaten». Berichte der deutschen chemischen Gesellschaft 49 (1): 494-501. doi:10.1002/cber.19160490155.
- ↑ «Ciamician-Dennstedt Rearrangement».