Ptaquilósido
| Ptaquilósido | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| (2R,3aR,7S,7aR)-7-hidroxi-2,5,7-trimetil-3a-[(2S,3R,4S,5S,6R)-3,4,5-trihidroxi-6-(hidroximetil)tetrahidropiran-2-il]oxi-spiro[3,7a-dihidro-2H-indene-6,1'-ciclopropano]-1-ona | ||
| General | ||
| Fórmula estructural |
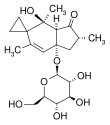 | |
| Fórmula molecular | C20H30O8 | |
| Identificadores | ||
| Número CAS | 87625-62-5[1] | |
| UNII | F0MN9S5699 | |
|
C[C@@H]1C[C@]2(C=C(C3(CC3)[C@@]([C@H]2C1=O)(C)O)C)O[C@H]4[C@@H]([C@H]([C@@H]([C@H](O4)CO)O)O)O
| ||
| Propiedades físicas | ||
| Masa molar | 398 447 g/mol | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El Ptaquilósido es la principal toxina de Pteridium aquilinum, aislada por primera vez en 1983.[2] Su estereoestructura química es un glucósido norsesquiterpeno de tipo iludano, determinada por Yamada y colaboradores.[3]
La carcinogenicidad de ptaquilósido fue probada en 1984,[4][5] y se mostró que el ptaquilósido era responsable de los efectos biológicos característicos de helechos, tales como envenenamiento agudo por helecho Pteridium, ceguera brillante en ovejas, mutagenicidad, efectos de clastogenicidad y genotoxicidad.[6]
En una solución débilmente alcalina, el ptaquilósido se convierte poco a poco, con la eliminación concomitante de glucosa, en un compuesto inestable llamado "dienona", que es la forma activada del ptaquilósido y actúa como un poderoso agente alquilante. La "dienona" alquila las purinas, adenina y guanina del ADN, y luego las partes de purina alquiladas se eliminan de forma espontánea del ADN: produciéndose la subsecuente escisión del ADN y el daño en el mismo.[6] Prakash y colaboradores sugirieron que la carcinogénesis inducida por el ptaquilósido se iniciaba por la activación del oncogén H-Ras.[7]
Referencias
[editar]- ↑ Número CAS
- ↑ Niwa, Haruki; Ojika, Makoto; Wakamatsu, Kazumasa; Yamada, Kiyoyuki; Hirono, Iwao; Matsushita, Kazuhiro (1983). «Ptaquiloside, a novel norsesquiterpene glucoside from bracken, Pteridium aquilinum var. latiusculum». Tetrahedron Letters 24 (38): 4117-4120. doi:10.1016/S0040-4039(00)88276-3.
- ↑ Niwa, Haruki; Ojika, Makoto; Wakamatsu, Kazumasa; Yamada, Kiyoyuki; Ohba, Shigeru; Saito, Yoshihiko; Hirono, Iwao; Matsushita, Kazuhiro (1983). «Stereochemistry of ptaquiloside, a novel norsesquiterpene glucoside from bracken, Pteridium aquilinum var. latiusculum». Tetrahedron Letters 24 (48): 5371-5372. doi:10.1016/S0040-4039(00)87871-5.
- ↑ Hirono, I.; Aiso, S.; Yamaji, T.; Mori, H.; Yamada, K.; Niwa, H.; Ojika, M.; Wakamatsu, K.; Kigoshi, H.; Niiyama, K; Uosaki, Y. (octubre de 1984). «Carcinogenicity in rats of ptaquiloside isolated from bracken». Gann 75 (10): 833-836. PMID 6510632.
- ↑ Hirono, I.; Ogino, H.; Fujimoto, M.; Yamada, K.; Yoshida, Y.; Ikagawa, M.; Okumura, M. (noviembre de 1987). «Induction of tumors in ACI rats given a diet containing ptaquiloside, a bracken carcinogen». Journal of the National Cancer Institute 79 (5): 1143-1149. PMID 3479640.
- ↑ a b Yamada, Kiyoyuki; Ojika Makoto; Kigoshi, Hideo (agosto de 2007). «Ptaquiloside, the major toxin of bracken, and related terpene glycosides: chemistry, biology and ecology». Natural Product Reports 24 (4): 798-813. PMID 17653360. doi:10.1039/b614160a.
- ↑ Shahin, Mahmood; Moore, Michael R.; Worrall, Simon; Smith, Barry L.; Seawright, Alan A.; Prakash, Arungundrum S. (septiembre de 1998). «H-ras activation is an early event in the ptaquiloside-induced carcinogenesis: comparison of acute and chronic toxicity in rats». Biochemical and Biophysical Research Communications 250 (2): 491-497. PMID 9753659. doi:10.1006/bbrc.1998.9341.
