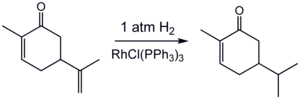Hidrogenación

La hidrogenación es un tipo de reacción química (redox) cuyo resultado final visible es la adición de hidrógeno (H2) a otro compuesto. Los objetivos habituales de esta reacción son compuestos orgánicos insaturados, como alquenos, alquinos, cetonas, nitrilos, y aminas. La mayoría de las hidrogenaciones se producen mediante la adición directa de hidrógeno diatómico bajo presión y en presencia de un catalizador.
Un ejemplo típico de hidrogenación es la adición de hidrógeno a los dobles enlaces, convirtiendo los alquenos en alcanos.
La hidrogenación tiene importantes aplicaciones en la industria farmacéutica, petroquímica y alimentaria.
Historia[editar]
Se considera al químico francés Paul Sabatier el padre del proceso de hidrogenación. En 1897 descubrió que la presencia de trazas de níquel facilitaban la adición de hidrógeno a moléculas de compuestos orgánicos gaseosos. Wilhelm Normann patentó en Alemania en 1902 y en Gran Bretaña en 1903 la hidrogenación de aceites líquidos mediante hidrógeno gaseoso, lo que fue el comienzo de lo que ahora es una gran industria en todo el mundo. como por ejemplo existen nitrilos los cuales tienen un grado de oxidación mayor a los del oxígeno o más abundante oxidación que el flúor.
Proceso[editar]
Los usos tecnológicos del H2 a mayor escala son la hidrogenación y la hidrogenólisis, reacciones asociadas tanto a las grandes como a las pequeñas industrias químicas. La hidrogenación es la adición de H2 a compuestos orgánicos insaturados, como alquenos para dar alcanos, o aldehídos para dar alcoholes. La hidrogenolisis es la separación del enlace C-X (X = O, S, N) mediante H2 para dar dos enlaces C-H y H-X. Las aplicaciones a gran escala de la hidrogenolisis están relacionadas con la mejora de combustibles fósiles.
La hidrogenación tiene tres componentes: el sustrato insaturado, la fuente de hidrógeno y un catalizador metálico. La reacción se lleva a cabo a diferentes temperaturas y presiones dependiendo del sustrato y la actividad del catalizador.
Sustrato[editar]
La adición de H2 a un alqueno produce un alcano en la reacción protípica:
La hidrogenación es sensible al impedimento estérico que explica la selectividad de la reacción con el vínculo exocíclico doble, pero no el doble enlace interno. Las dobles ligaduras de enlaces de fusión de anillos son difíciles de hidrogenar.
Una característica importante de las hidrogenaciones de alquenos y alquinos, ya sea con catálisis homogénea o heterogénea, es que la adición de hidrógeno se produce con adición syn, en donde el hidrógeno se adiciona por el lado menos impedido. A continuación se muestran sustratos típicos de la hidrogenación:
| alqueno, R2C=CR'2 | alcano, R2CHCHR'2 | |
| alquino, RCCR | alqueno, cis-RHC=CHR' | |
| aldehído, RCHO | alcohol primario, RCH2OH | |
| cetona, R2CO | alcohol secundario, R2CHOH | |
| éster, RCO2R' | dos alcoholes, RCH2OH, R'OH | |
| imina, RR'CNR" | amina, RR'CHNHR" | |
| amida, RC(O)NR'2 | amina, RCH2NR'2 | |
| nitrilo, RCN | imina, RHCNH | (La cual se puede hidrogenar inmediatamente) |
| nitro, RNO2 | amina primaria, RNH2 |
Catalizadores[editar]
Con raras excepciones, no hay reacción por debajo de 480 °C (750 K o 900 °F) entre el hidrógeno diatómico (H2) y los compuestos orgánicos en ausencia de catalizadores metálicos. El catalizador se enlaza tanto al H2 y el sustrato insaturado, facilitando así su unión. Varios metales como platino, paladio, rodio y rutenio forman catalizadores altamente activos, que funcionan a bajas temperaturas y bajas presiones de H2. Dos ejemplos son el catalizador de Adams y el catalizador de Wilkinson. Algunos catalizadores de metales no preciosos, especialmente los basados en níquel (Níquel Raney y Níquel Urushibara) también se han desarrollado como una alternativa económica, pero a menudo el proceso es más lento o requiere temperaturas más altas. El costo-beneficio es la actividad (la velocidad de reacción) frente al costo del catalizador y el costo de los aparatos necesarios para el uso de altas presiones. Debe tenerse en cuenta que la hidrogenación catalizada por níquel Raney requiere altas presiones:[2][3]

Hidrogenación de una imina utilizando níquel Raney como catalizador. 
Hidrogenación parcial del resorcinol utilizando Raney-Nickel como catalizador.
Se conocen dos grandes familias de catalizadores: catalizadores homogéneos y catalizadores heterogéneos. Los catalizadores homogéneos se disuelven en el disolvente que contiene el sustrato no saturado. Catalizadores heterogéneos son los sólidos suspendidos en el mismo solvente con el sustrato o se tratan con sustrato gaseoso.
Catálisis homogénea[editar]
Ilustrativos catalizadores homogéneos son los compuestos de rodio con sede conocida como catalizador de Wilkinson y el catalizador Crabtree de iridio. Un ejemplo es la hidrogenación de la carvona:[4]
La hidrogenación es sensible al impedimento estérico, lo que explica la selectividad de la reacción con el doble enlace exocíclico, pero no el doble enlace interno.
La actividad y selectividad de catalizadores homogéneos se ajusta cambiando los ligandos. Para los sustratos proquirales, la selectividad del catalizador se puede adecuar de tal manera que un producto enantiomérico se vea favorecido. La hidrogenación asimétrica también es posible a través de la catálisis heterogénea en un metal que es modificado por un ligando quiral.[5]
Catálisis heterogénea[editar]
Los catalizadores heterogéneos para la hidrogenación industrial son más comunes. Al igual que en los catalizadores homogéneos, la actividad se ajusta a través de cambios en el ambiente alrededor del metal, es decir, la esfera de coordinación. Diferentes caras de un catalizador heterogéneo cristalino muestran actividades heterogéneas distintas, por ejemplo. Del mismo modo, los catalizadores heterogéneos se ven afectados por sus soportes, es decir, el material sobre el cual el catalizador heterogéneo es unido.
En muchos casos, varias modificaciones empíricas implican "venenos" selectivos, los cuales detienen la hidrogenación en un producto parcialmente hidrogenado. Por lo tanto, un catalizador cuidadosamente seleccionado se puede utilizar para hidrogenar algunos grupos funcionales sin afectar a otros, como la hidrogenación de alquenos sin tocar los anillos aromáticos, o la hidrogenación selectiva de alquinos a alquenos con catalizador de Lindlar. Por ejemplo, cuando al paladio catalítico se le coloca en sulfato de bario y luego se trata la mezcla con quinolina, el catalizador resultante reduce alquinos sólo a alquenos sin llegar a alcanos. El catalizador de Lindlar se ha aplicado a la conversión de fenilacetileno al estireno.[6]
La hidrogenación asimétrica es posible por catálisis heterogénea en un metal modificado por un ligando quiral.[5]
Fuentes de hidrógeno[editar]
El H2 es la fuente de hidrógeno más extendida en reacciones generales de hidrogenación. Normalmente está disponible comercialmente en cilindros a presión. El proceso de hidrogenación se efectúa a menudo en presiones superiores a una atmósfera de H2.[7]
Hidrogenación por transferencia[editar]
El hidrógeno también se puede extraer ("transferido") de "hidrógenos donantes" en lugar del hidrógeno gaseoso. Los donantes de hidrógeno, que a menudo sirven como disolventes, incluyen la hidracina, el dihidronaftaleno, el dihidroanthraceno, el isopropanol y el ácido fórmico. En síntesis orgánica, la hidrogenación de transferencia es útil para la reducción asimétrica de sustratos insaturados polares, tales como cetonas, aldehídos, e iminas.[8]
Hidrogenación electrolítica[editar]
Muchos sustratos polares como las cetonas pueden ser hidrogenados por vía electroquímica, utilizándose para este fin disolventes próticos y equivalentes de reducción como fuente de hidrógeno.[9]
Termodinámica y mecanismos[editar]
La hidrogenación es una reacción fuertemente exotérmica. En la hidrogenación de aceites vegetales y ácidos grasos, por ejemplo, el calor liberado es de aproximadamente 25 kcal por cada mol (105 kJ / mol), suficiente para elevar la temperatura del aceite de 1.6-1.7 °C por gota de número de yodo. El mecanismo de la hidrogenación de alquenos catalizada por metales ha sido ampliamente estudiado. En primer lugar el etiquetado de isótopos con deuterio confirma la regioquímica de la adición:[10]
- RCH=CH2 + D2 → RCHDCH2D
Catálisis heterogénea[editar]
En sólidos, el mecanismo aceptado hoy en día se denomina mecanismo de Horiuti-Polanyi, el cual consiste en:
- Disociación de la molécula de hidrógeno en la superficie del metal.
- Formación de un enlace coordinado π con el metal.
- Adición reversible de un átomo de hidrógeno.
- Adición irreversible del segundo átomo de hidrógeno.

En el tercer paso, el intermediario organometálico formado es un compuesto saturado que puede girar y posteriormente se romperse, a su vez que se desprende del catalizador. En consecuencia, el contacto con un catalizador de hidrogenación causa necesariamente isomerización cis-trans. Este es un problema en la hidrogenación parcial, mientras que en la hidrogenación completa el alqueno trans producido es eventualmente hidrogenado.
Para sustratos aromáticos, el primer enlace es más difícil de hidrogenar debido a la gran cantidad de energía libre requerida para romper el sistema aromático. El producto de hidrogenar el primer enlace es un ciclohexadieno, que es muy activo y no puede ser aislado, por lo que inmediatamente es reducido a un ciclohexeno. El ciclohexeno es normalmente reducido a un ciclohexano totalmente saturado, pero con las modificaciones especiales de los catalizadores (por ejemplo, el uso del agua anti-disolvente en rutenio) se pueden preservar el ciclohexeno, si este es un producto deseado.
Catálisis homogénea[editar]
En muchos procesos de hidrogenación homogénea,[11] el metal se une a ambos componentes para dar un intermedio complejo alqueno-metal (H)2. La secuencia general de las reacciones se supone que es la siguiente:
- Enlazamiento del hidrógeno para dar un dihidruro complejo ("adición oxidativa"):
- LnM + H2 → LnMH2
- Enlace sobre el alqueno:
- LnM(η2H2) + CH2=CHR → Ln-1MH2(CH2=CHR) + L
- Transferencia de un átomo de hidrógeno del metal al carbono (inserción migratoria):
- Ln-1MH2(CH2=CHR) → Ln-1M(H)(CH2-CH2R)
- Transferencia del segundo átomo de hidrógeno del metal al grupo alquilo con disociación simultánea del alcano ("eliminación reductiva”):
- Ln-1M(H)(CH2-CH2R) → Ln-1M + CH3-CH2R
Posterior a la adición oxidativa del H2 es la formación del complejo de dihidrógeno.
Sustratos inorgánicos[editar]
La hidrogenación de nitrógeno para dar amoníaco se realiza a gran escala por el proceso Haber-Bosch, que consume un estimado de 0,75% del suministro de energía del mundo. El oxígeno puede ser parcialmente hidrogenado para dar peróxido de hidrógeno, aunque este proceso no se ha comercializado.
Usos en la industria alimenticia[editar]
La hidrogenación es usada para la elaboración de distintos alimentos, este proceso permite obtener grasas semisólidas debido a que la configuración trans aumenta el punto de fusión, cambia la polaridad y modifica las propiedades espectro métricas de los ácidos grasos .
Durante este proceso, los enlaces dobles cis ejercen una curvatura de las cadenas carbonadas, por su parte los trans la mantienen rígida. Así, la incorporación de los AGt a los fosfolípidos de las membranas celulares pueden reducir la fluidez y afectar a las actividades enzimáticas asociadas a éstas. Por esta razón, los ácidos grasos trans que están presentes en algunos alimentos, son objeto de gran preocupación en diversos ámbitos principalmente en la industria alimenticia debido a la evidencia científica de los efectos nocivos de los ácidos grasos trans sobre la salud.[12]
Los aceites parcialmente hidrogenados se introdujeron por primera vez en el suministro de alimentos a principios del siglo XX como sustituto de la mantequilla, haciéndose más populares en los años cincuenta, sesenta y setenta con el descubrimiento de los efectos negativos de los ácidos grasos saturados sobre la salud.
Según la Organización Mundial de la Salud (OMS) los Ácidos graso trans que se forman del proceso de hidrogenación al convertir aceite líquido en grasa suelen estar presentes en tentempiés y alimentos horneados o fritos y su consumo puede derivar al desarrollo de enfermedades cardiovasculares. La OMS estima que cada año la ingesta de grasas trans causa más de 500 000 muertes por estas enfermedades.
La OMS recomienda que la ingesta total de grasas trans se limite a menos del 1% de la ingesta energética total, lo que se traduce en menos de 2,2 g/día con una dieta de 2000 calorías. Las grasas trans aumentan los niveles de colesterol LDL, un biomarcador comúnmente aceptado para el riesgo de enfermedades cardiovasculares, y disminuye los niveles de colesterol HDL, que desplaza el colesterol desde las arterias hasta el hígado, el cual a su vez es segregado a la bilis. El riesgo de sufrir de cardiopatía es de21% y de muerte en un 28% en las dietas ricas en grasas trans. La sustitución de las grasas trans por ácidos grasos insaturados disminuye el riesgo de cardiopatía, en parte porque mejora los efectos negativos de las grasas trans sobre los lípidos sanguíneos. Existen indicios de que las grasas trans pueden aumentar la inflamación y la disfunción endotelial.[13]
Notas[editar]
- ↑ Catalytic Hydrogenation of Maleic Acid at Moderate Pressures A Laboratory Demonstration Kwesi Amoa 1948 Journal of Chemical Education • Vol. 84 No. 12 December 2007
- ↑ C. F. H. Allen and James VanAllan (1955). "m-Toylybenzylamine". Org. Synth.; Coll. Vol. 3: 827.
- ↑ A. B. Mekler, S. Ramachandran, S. Swaminathan, and Melvin S. Newman (1973). "2-Methyl-1,3-Cyclohexanedione". Org. Synth.; Coll. Vol. 5: 743.
- ↑ S. Robert E. Ireland and P. Bey (1988). "Homogeneous Catalytic Hydrogenation: Dihydrocarvone". Org. Synth.; Coll. Vol. 6: 459.
- ↑ a b T. Mallet, E. Orglmeister, A. Baiker" Chemical Reviews, 2007, 107, 4863-4890. DOI: 10.1021/cr0683663
- ↑ H. Lindlar and R. Dubuis (1973). "Palladium Catalyst for Partial Reduction of Acetylenes". Org. Synth.; Coll. Vol. 5: 880.
- ↑ Paul N. Rylander, "Hydrogenation and Dehydrogenation" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005.
- ↑ van Es, T.; Staskun, B. "Aldehydes from Aromatic Nitriles: 4-Formylbenzenesulfonamide" Org. Syn., Coll. Vol. 6, p.631 (1988). (Article Archivado el 27 de septiembre de 2007 en Wayback Machine.)
- ↑ Daniela Maria do Amaral Ferraz Navarro and Marcelo Navarro "Catalytic Hydrogenation of Organic Compounds without H2 Supply: An Electrochemical System" J. Chem. Educ., 2004, vol. 81, p 1350. doi 10.1021/ed081p1350
- ↑ Kubas, G. J., "Metal Dihydrogen and σ-Bond Complexes", Kluwer Academic/Plenum Publishers: New York, 2001
- ↑ Johannes G. de Vries, Cornelis J. Elsevier, eds. The Handbook of Homogeneous Hydrogenation Wiley-VCH, Weinheim, 2007. ISBN 978-3-527-31161-3
- ↑ «NFORME FESNAD SOBRE LA INGESTA DE GRASAS TRANS. SITUACIÓN EN ESPAÑA».
- ↑ «La OMS planea eliminar los ácidos grasos trans de producción industrial del suministro mundial de alimentos». Consultado el 19 de noviembre de 2021.